技術・研究材料紹介(企業広告)
マイクロドーズ試験による臨床投与量でのPK予測
積水メディカル株式会社 薬物動態研究所
伊藤諭史,山田君保,鷲野 亨,神村秀隆
1. はじめに
マイクロドーズ臨床試験は安全性に問題を生じない極めて微量の薬物を被験者に投与し,臨床投与量での体内動態を予測する技術である.本技術の検証が開始された2000年代前半には,その予測性を数値化できる充分なデータは得られていなかった.しかし,2013年にLappin et al.1) によって臨床投与量でのpharmacokinetics (PK) の予測性を評価した論文が発表された.本稿では,その報告内容を紹介する.また,臨床投与量の非標識体を経口投与すると共に,極めて微量の放射性標識体を投与するマイクロトレーサー試験や,積水メディカル(株)で取り組んでいる関連試験の受託体制についても述べる.
2. マイクロドーズによる臨床PKパラメーターの予測
上記論文1)によると,11種の静脈内投与によるマイクロドーズ試験(後述するマイクロトレーサー試験も含む)では,何れの化合物も,臨床投与量での試験に極めて近いクリアランス(CL)が得られた.また,分布容積(Vd)に関してもアセトアミノフェン,ミダゾラム等で多少の乖離が認められたが,その差は2倍以内であり,静脈内投与に関しては,マイクロドーズ試験による臨床投与量でのPK予測率はほぼ100%と推察された.
一方,経口投与では,薬物の吸収過程が溶解性,膜透過性や消化管での代謝や薬物トランスポーターの影響を受けることから,臨床PKの予測は難度が高まる.そこで対象薬物を,生物薬剤学にて用いられるBiopharmaceutics Drug Disposition Classification System (BDDCS)2)に基づいて分類,評価が行われた.その結果,Class I(高溶解性,易代謝性)に分類される10種の薬物のうち9種類で満足できる結果が得られた.そして,Class III(高溶解性,難代謝性)に分類される薬物でも,6種中1種(セリプロロール)を除けばその予測性は良好であった.また,BDDCS分類が不明の3種の開発化合物(ZK253, IDX899, α1A-adrenoceptor antagonist)も全て良好の判定となった.これに対し,Class II(低溶解性,易代謝性)に分類された薬物では,6種中3種(プロパフェノン,テルミサルタン,ワルファリン)でF(%)あるいはピーク形状に不満が残った.Class IならびにClass IIIの薬物の予測性が高かったことから,これは薬物の溶解性(微量投与時の吸着)に起因している,あるいはワルファリンの様に,low-capacityの特異的結合部位の飽和によるものと予想される.今回対象となった化合物を総合すると,経口投与後に65%の薬物がマイクロドーズと薬効臨床投与量でのPKの乖離が2倍以内であり,特にClass I,IIIの化合物の予測性は従来法3,4)と同等あるいはそれ以上に高いものと推察される.
3. 第I相試験開始以降のマイクロトレーサーによる薬物動態試験
広い意味ではマイクロドーズ試験の範疇に含まれるが,臨床投与量の非標識体と共に,極めて微量の放射性標識体を投与するマイクロトレーサーによって,バイオアベイラビリティ(BA)試験5)を実施することができる.例えば非標識体経口投与後,予想した最高濃度に達する時点で,14C-標識した試験薬物を静脈内投与する.そして,血漿中の非標識体をLC/MS/MSで,標識体を加速器質量分析法(AMS)で測定してCL, Vd, BA等を算出する.
一方,微量の14C-標識体を被験薬に混合して,経口投与のみを実施するマスバランス試験6)も実施し得る.そして,尿,糞等に回収される標識体の量をAMSで測定することにより,未変化体ならびに代謝物の主要な消失経路を把握し,試験対象薬物の物質収支を明らかにすることが可能となる.
4. 積水メディカル㈱のマイクロドーズ/マイクロトレーサー試験実施体制
マイクロドーズ試験は,医薬品開発を促進させる新技術としてFDAガイダンス7),ICH M3 (R2)8) によって試験実施に関する国際的な調和が図られた.日本国内でも厚生労働省より当該ガイダンス9) が発出され,2008年10月よりNEDOプロジェクト「マイクロドーズ臨床試験を活用した革新的創薬技術の開発」が開始された.本プロジェクトは,(社)医薬品開発支援機構(APDD)が,新エネルギー・産業技術総合開発機構(NEDO)より研究委託を受けて推進し,種々の成果が生み出された10,11).
積水メディカル㈱は,プロジェクト発足時よりAPDDの分室の一つとして機能し,2008年にはキニジン,ベラパミル,2009年には14C-アセトアミノフェン,14C-トルブタミド,メトフォルミン,そして2010年にはフェキソフェナジン,ミダゾラム,その他多くの薬物を対象とした試験に関与してきた.マイクロドーズ臨床試験は,従来の臨床試験と比較して,大幅に実施要項が緩和されている.しかし,あくまでヒトを対象とした試験であり,実施期間中は被験者の安全性を確保することが最優先課題となる.また,試験に供する治験薬の品質保証も試験実施者の責務である.将来的に承認申請時に試験データを提出する必要もあり,弊社として治験薬GMP,GCP省令に則って,当該試験を安全,且つ円滑に実施できる体制を構築しつつある(Fig.1).製薬企業からは一連のマイクロドーズ関連試験を総合的に受託できるCROの存在が求められており12),微力ながら新薬開発に資することができれば幸いである.
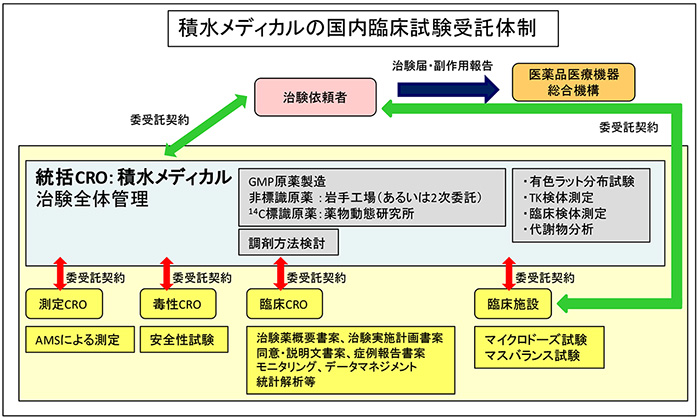
Fig. 1 積水メディカル(株)における国内臨床試験受託体制
参考文献
- Lappin G et al. Expert Opin Drug Metab Toxicol 9:817-834 (2013).
- Wu CY, Benet L.Z. Pharm Res 22:11-23 (2005).
- Rowland, M. and Benet, L.Z. J. Pharm. Sci 100:4047-4049 (2011).
- Zhang T et al. J Pharm Sci. Feb 17. (2015) [Epub ahead of print]
- Miyaji Y et al. Drug Metab Pharmacokinet 24:130-138 (2009).
- 野口英世,RADIOISOTOPES, 52:195-202 (2003).
- FDA CDER, Guidance for industry, Investigators and reviewers, Exploratory IND studies. 12 January (2006).
- ICH, Guidance on nonclinical safety studies for the conduct of human clinical trials and marketing authorization for pharmaceuticals M3 (R2). 11 June (2009).
- 厚生労働省 薬食審査発第0603001号,平成20年6月3日
- 杉山雄一,医薬ジャーナル 46:229-237 (2010).
- 栗原千絵子,Isotope News No.696 (2012).
- Kim S. Yakugaku Zasshi 134:459-63 (2014).
