トピックス
第33回年会シンポジウム「薬物動態・毒性領域における新規評価ツールとその規制
(Novel drug developmental tools on DMPK/toxicity and their regulation)」
 |
Non-clinical safety assessment of regenerative medical products derived from iPS cells(独)医薬品医療機器総合機構 再生医療製品等審査部
|
はじめに
再生医療等製品には,ヒト細胞加工製品や遺伝子治療用製品があり,近年では遺伝子改変を加えた細胞加工製品も開発されている(図1).近年,本邦においてiPS細胞由来ドパミン神経前駆細胞のパーキンソン病患者に対する治験が開始され,またiPS細胞由来の心筋細胞シート,網膜色素上皮細胞,血小板等のiPS細胞加工製品の開発が進んでいることから,本講演では独立行政法人 医薬品医療機器総合機構(以下,「PMDA」)におけるレギュラトリーサイエンス戦略相談の事例を踏まえて,ヒトiPS細胞加工製品の非臨床安全性評価に関して解説した.なお,本講演は講演者の個人的見解に基づくものであり,PMDAの公式な見解を示すものではない.
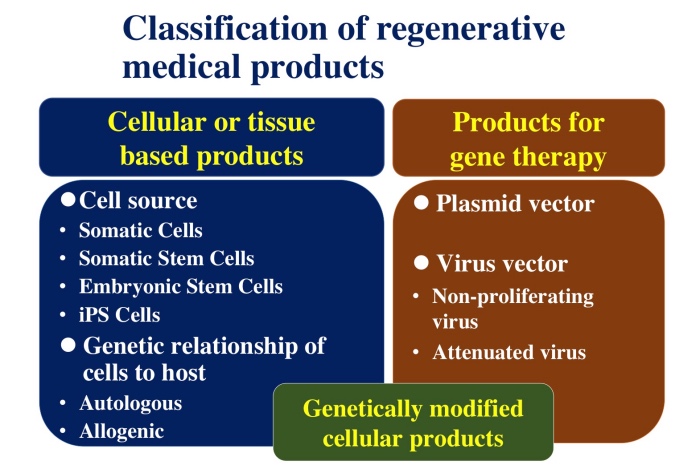
ヒトiPS細胞加工製品には関連する経験や知見の蓄積が極めて乏しいことから,ヒトに投与する前には,安全性を特に慎重に確保する必要がある.ヒトiPS細胞加工製品の安全性評価についての基本的な考え方は,「ヒト(自己)iPS(様)細胞加工医薬品等の品質及び安全性の確保について」(平成24年9月7日付け薬食発0907第4号)及び「ヒト(同種)iPS(様)細胞加工医薬品等の品質及び安全性の確保について」(平成24年9月7日付け薬食発0907第5号)に示されている.また,より具体的な考え方については,「再生医療等製品(ヒト細胞加工製品)の品質,非臨床試験及び臨床試験の実施に関する技術的ガイダンスについて」(平成28年6月27日付け 厚生労働省医薬・生活衛生局 医療機器審査管理課 事務連絡)において,ヒトiPS細胞加工製品も含むヒト細胞加工製品の非臨床安全性評価に関するPMDAの考え方が示されている.ヒトiPS細胞加工製品の臨床試験開始前に必要な非臨床安全性評価は,細胞成分,非細胞成分(目的とする細胞・組織以外の材料,例えば細胞凍結保護液等)及び製造工程由来不純物の安全性評価である.以下,細胞成分の非臨床安全性評価について解説した後に,非細胞成分及び製造工程由来不純物の非臨床安全性評価について概説する.
細胞成分の非臨床安全性評価
細胞成分に対する安全性評価としては,一般毒性評価及び造腫瘍性評価が必要である.造腫瘍性とは,動物又はヒトに移植された細胞が増殖することにより,腫瘍を形成する能力のことである.ヒトiPS細胞加工製品の細胞成分に対する非臨床安全性評価においては,ヒトと動物の生物学的な種差やヒトiPS細胞加工製品の細胞成分に対する動物の異種免疫反応により動物を用いた試験に基づく安全性評価が困難になる場合があること,PKや薬物動態解析に基づく定量的なリスク評価が困難であること等の問題がある.したがって,細胞成分の非臨床安全性評価のための動物を用いた試験で得られる安全性情報は限定的であり,ハザード評価が目的となる.ヒトiPS細胞加工製品の細胞成分に関する非臨床安全性試験の実施においては,原則として,臨床試験で用いる予定の最終製品を被験物質とすることが推奨される.非臨床安全性試験の被験物質と,臨床試験で用いる予定の最終製品が異なる場合には,非臨床安全性試験の被験物質と臨床試験で用いる最終製品の品質に関する一貫性をデータに基づき示す必要がある.また,ヒトiPS細胞加工製品を用いた非臨床安全性試験には,目的とする細胞成分が生体内で一定期間生着することが期待される免疫不全動物又は免疫抑制剤投与下の動物が用いられることが多い.
一般毒性試験の実施に当たっては,「医薬品の製造(輸入)承認申請に必要な毒性試験のガイドラインについて」(平成元年9月11日付け薬審1第24号)の別添「医薬品毒性試験法ガイドライン」等を参照し,動物数,性,観察及び検査項目等を設定することが適切である.一般毒性試験においては,1種の動物を用いて,臨床投与経路で投与可能な最大量の被験物質を投与することが一般的である.試験に用いる動物は,最終製品に期待される効果や性能が評価可能であること,被験物質に対する異種免疫反応が回避できること(免疫不全動物の使用,免疫抑制剤投与等),解剖学的にヒトと類似していること等の観点から,製品の特性を考慮して適切な動物を選択する.被験物質は臨床試験で用いる最終製品とすることが推奨されるが,例えば最終製品と類似した動物由来のiPS細胞加工製品等,最終製品以外の被験物質を用いる場合には,その適切性について説明が必要となる.一般毒性試験においては全身及び局所毒性を評価し,主要な生理的機能(中枢神経系,心血管系及び呼吸器系)に対する特段の懸念がないことを確認する.
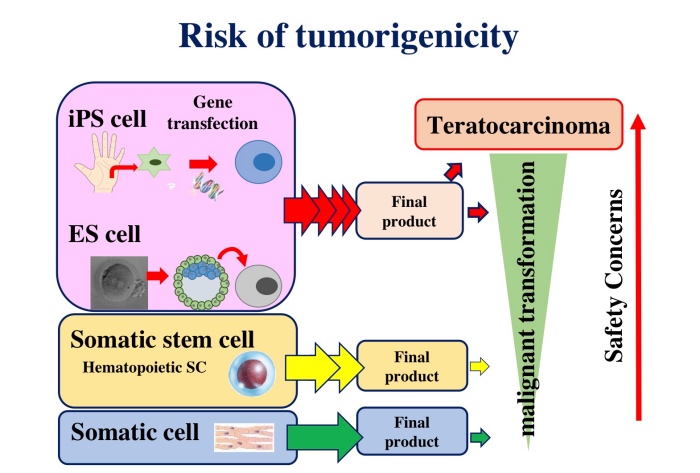
また,細胞成分の造腫瘍性評価について,ヒトiPS細胞加工製品は,一般的に体細胞加工製品や体性幹細胞加工製品と比較して,最終製品までの製造工程が複雑であること及びiPS細胞は奇形腫形成能を有することから,造腫瘍性の懸念が高い(図2).したがって,ヒトに投与する前には,製品の特性に応じて適切な造腫瘍性試験を実施し,造腫瘍性評価をする必要がある.具体的には,ヒトiPS細胞加工製品の造腫瘍性評価については,最終製品中に残存する未分化iPS細胞によるものと,最終製品の悪性形質転換によるものの2つの観点から評価する必要がある.最終製品中に残存する未分化iPS細胞による造腫瘍性評価のために,製造に用いたiPS細胞を動物に投与する造腫瘍性試験を実施し,当該試験成績に基づき最終製品のiPS細胞の残存に関する品質管理の適切性を検討する必要がある.また,最終製品の製造過程で生じる懸念のある悪性形質転換細胞による造腫瘍性は,移植部位の微小環境に影響を受ける可能性があることから,実施可能であれば臨床適用経路による動物を用いた造腫瘍性試験において評価することが望ましい.臨床適用経路による評価が技術的に困難な場合には,他の投与経路による評価も考えられるが,その場合には,投与経路の差異による影響を十分に説明することが重要である.
非細胞成分及び製造工程由来不純物の非臨床安全性評価
非細胞成分の安全性評価については,各成分の特性や含有量を踏まえ,公表データ等から評価することが適切である.その上で,非細胞成分の安全性評価を目的とした非臨床安全性試験を別途実施する必要が生じた場合には,医薬品や医療機器の非臨床安全性評価に関するガイドライン等を参考に,非臨床安全性試験を立案する.
製造工程由来不純物については,不純物に起因するリスクを特定する前に,まずは製造工程において可能な限り除去することが重要である.その上で,ヒトiPS細胞加工製品中の製造工程由来不純物の残存量(実測値又は推定値)及びヒトiPS細胞加工製品の臨床投与量に基づき,臨床でヒトに曝露される製造工程由来不純物の量を算出した上で,ヒトへの安全性を評価する必要がある.安全性評価においては,公表データや最終製品の非臨床安全性試験から得られた情報を踏まえ,安全性を評価することが適切である.公表データとしては,例えば,医薬品や医薬品添加剤としての臨床使用経験,ヒト内因性物質については血中濃度等,食品添加物として市販されている場合には許容摂取量,非臨床試験の無毒性量や最小薬理作用量,不純物に関するICHガイドライン(「医薬品の残留溶媒ガイドラインについて」(平成10年3月30日付け医薬審第307号(ICH Q3C),「医薬品の元素不純物ガイドラインについて」(平成27年9月30日付け薬食審査発0930第4号)(ICH Q3D),「潜在的発がんリスクを低減するための医薬品中DNA反応性(変異原性)不純物の評価及び管理ガイドラインについて」(平成27年11月10日付け薬生審査発1110第3号(ICH M7)等),毒性学的懸念の閾値等が含まれる.これらのアプローチを利用してもヒトでの安全性が評価できない場合には,非細胞成分と同様に,不純物の安全性評価を目的とした非臨床安全性試験を実施することが適切である.
おわりに
本講演ではiPS細胞加工製品の非臨床安全性評価について概説した.実際のiPS細胞加工製品の開発においては,製品の特性を把握した上で,”ケース・バイ・ケース”での安全性評価をする必要があるため,より有効で安全なiPS細胞加工製品が遅滞なく開発されるよう,PMDAで実施している薬事戦略相談等のご活用をお願いしたい.



