トピックス
第33回年会シンポジウム「薬物動態・毒性領域における新規評価ツールとその規制
(Novel drug developmental tools on DMPK/toxicity and their regulation)」
 |
ヒトiPS細胞技術を活用した新たな安全性評価法の開発と国際標準化への取り組み国立医薬品食品衛生研究所 薬理部
|
1.はじめに
ヒトiPS細胞技術が開発されたことにより,再生医療の実現のみならず新薬開発のストラテジーにも大きな改革をもたらした.この日本発の画期的な技術を創薬に活用するため,我々薬理部においてヒトiPS細胞由来分化細胞を利用して安全性薬理試験法を開発している.内閣府「健康・医療戦略」(2013年6月14日)においても,「新薬開発の効率性の向上を図るため,iPS細胞を用いた医薬品の安全性評価システムを開発する」と掲げられ,ヒトiPS細胞技術の出口戦略が期待されている.
ヒトiPS細胞由来分化細胞の中でも,特に分化心筋細胞を用いた安全性薬理試験が創薬への活用に向けて最も進んでいる.我々は,複数の研究施設で同一の化合物および計測機器を使うことにより再現性の高い共通プロトコルを整備してバリデーション研究を行った.催不整脈リスク予測のためのデータ解析指標などを提示して,国際的なバリデーション試験に参加して,評価法の再現性や信頼性に関する科学的根拠を取得した.現在,医薬品規制調和国際会議(The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use; ICH)において,ヒトiPS細胞由来心筋細胞などのin vitro評価法に関して議論が開始されている.さらに,副作用の重要な臓器として神経や肝臓などにも取り組んでおり,今後,新たな薬理試験法の開発が期待される.
本総説では,ヒトiPS細胞由来分化細胞を用いた新たな薬理試験法の開発と国際標準化に関して概説したい.
2.医薬品による催不整脈作用
医薬品によって発生する副作用の中で,Torsade de Pointes(TdP)とよばれる重篤な不整脈は突然死に至る症例が報告されており,その発生リスクを予測することは極めて重要である.例えば,抗アレルギー薬のテルフェナジンはTdPによる死亡例により市場から撤退し,その後も心電図QT延長やTdPによって市場撤退する薬物が相次いだ.このため,TdPのサロゲートマーカーとしてQT延長リスクを評価することが非臨床・臨床の両方で求められることとなった(ICH S7B及びE14ガイドライン).TdP誘発リスクは,非臨床試験としてin vitroで心筋細胞活動電位の再分極に重要なカリウム電流阻害作用およびin vivoで動物におけるQT延長作用を評価し(ICH S7Bガイドライン),臨床においてThorough QT/QTc試験を実施して厳密にヒトのQT間隔に対する作用を調べて(ICH E14ガイドライン),総合的にTdP誘発リスクを評価している.
ICH S7BとE14の施行により,QT延長およびTdPで市場撤退する医薬品は激減し,これらのガイドラインが安全性評価において一定の成功をおさめた.しかしながら,これらの試験の問題点も徐々に明らかになってきた.例えば,QT延長は必ずしもTdP誘発につながるとは限らないこと,カリウム電流への作用を調べる試験法であるhERG試験には臨床で発生するQT延長やTdPを予測する上で偽陽性が多いため,有効性の高い医薬品候補化合物が脱落し開発が進まないと思われること,臨床thorough QT試験では陽性対照物質を用いてその試験の信頼性を示さなくてはならず負担が大きいこと,などがあげられる(図1).そこで,安全性を担保しつつ,さらに予測性の高い手法が期待されており,複数のイオンチャネルを発現するヒトiPS細胞由来心筋細胞の利用が期待される(図1).
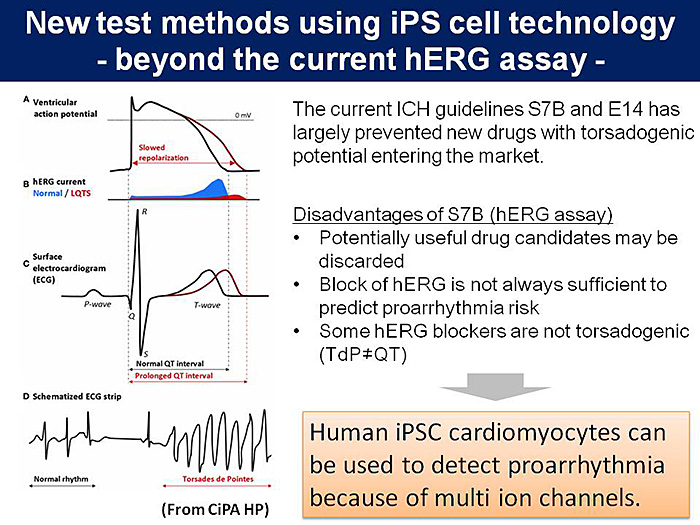
3.ヒトiPS細胞由来心筋細胞を利用した安全性薬理試験法の開発と国際標準化
我々はオールジャパンコンソーシアムであるJapan iPS Cardiac Safety Assessment (JiCSA) において,実験プロトコルを整備し,複数の研究室において同一の細胞標本と同一の薬理評価法,同一の薬剤を用いて再現性を検証した.検証試験では,市販のヒトiPS細胞由来心筋細胞の中で最も広く流通していたiCell心筋細胞(Cellular Dynamics International社)をモデルとして用いた.実験標本は2次元心筋シートを選択し,計測機器としてはQT延長に相当するフィールド電位のデータが得られる多点電極アレイ(MEA)システムを選択した.MEAにはガラス基板上に平面微小電極がパターニングされており,この電極上で心筋シートを形成させることで細胞外電位の測定が可能である.このiCell心筋細胞およびMEAの組み合わせにより,多施設間で実験データの再現性が得られる標準的なプロトコルを作成した.米国では食品医薬品局(Food and Drug Administration; FDA),環境保健科学研究所(Health and Environmental Sciences Institute; HESI)らが中心となってComprehensive in Vitro Proarrhythmia Assay (CiPA)を提案しており,我々はCiPAのmyocyteサブチームとプロトコルや予備データなどのデータシェアリングを行い,国際的な連携を図った.
次に,我々は標準プロトコルによる実験結果の再現性やデータのばらつきの程度などを検証するために,TdPリスクの異なる化合物を選定し,世界に先駆けて大規模検証試験を行った.図2に示すように,MEAデータセットと公的な臨床データベースCredibleMedsなどに基づいたTdPリスクとの相関により,ヒトiPS心筋細胞を用いた催不整脈リスク予測法の有用性を明らかにした(1).その一方で,細胞株が1種類であること,コード化していない化合物を用いたこと,統計処理を行っていないことなどの課題が認められた.
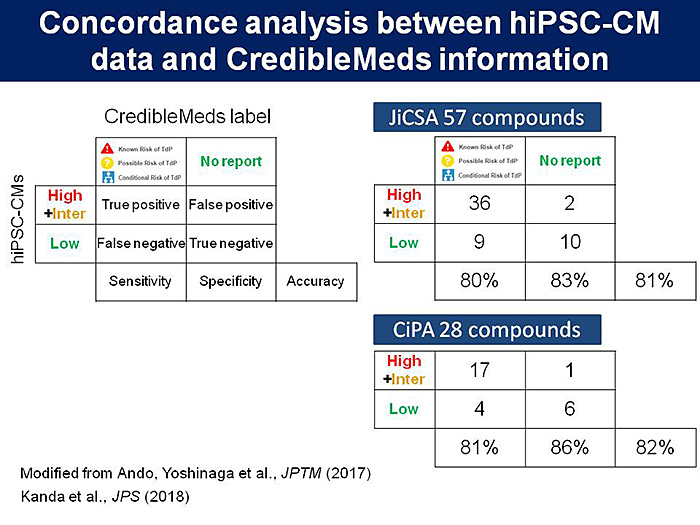
そこで,我々と同じMEAプロトコルを用いて,FDAらによって国際バリデーション試験が実施されることとなった.米国国立がん研究所(National Cancer Institute; NCI)からコード化された化合物が提供されて,10施設が参加してデータを取得し,日本からもデータセットを提供した.ヒトでのTdPリスクをもとにして28薬剤を選定して3つのリスクに分類し,MEAシステムによる国際検証試験を行ったところ,統計的な解析によりヒトiPS細胞由来心筋細胞を用いた方法は再現性が高く,高精度にヒトの薬剤誘発性のTdPリスクを分類できることを示した(2).さらに,日本独自のプロトコルやデータ解析により,薬剤のフリー体の濃度を加味することにより予測性がさらに向上することを明らかにして(3),HESI心毒性会議や国際安全性薬理学会などにおいてシンポジウムを企画して議論を行った(図3).
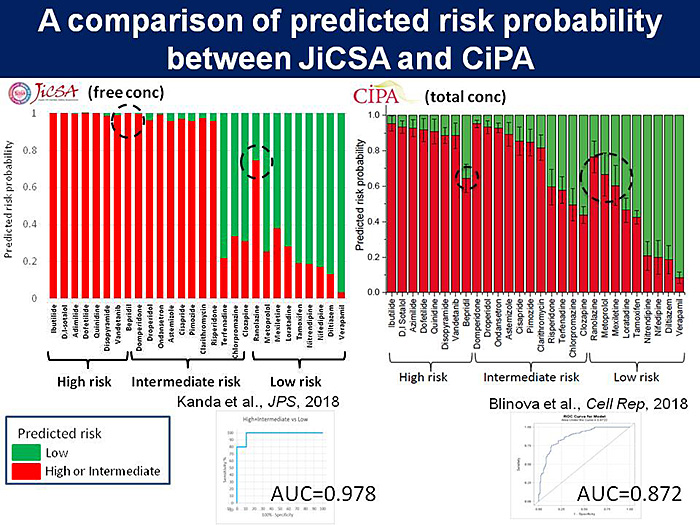
これらの科学的根拠をもとに,ICHにおいて,ヒトiPS細胞由来心筋細胞などのin vitro評価法に関してコンセプトペーパーが作成され,議論が開始されている.
4.心筋以外のヒトiPS細胞由来分化細胞を利用した評価法
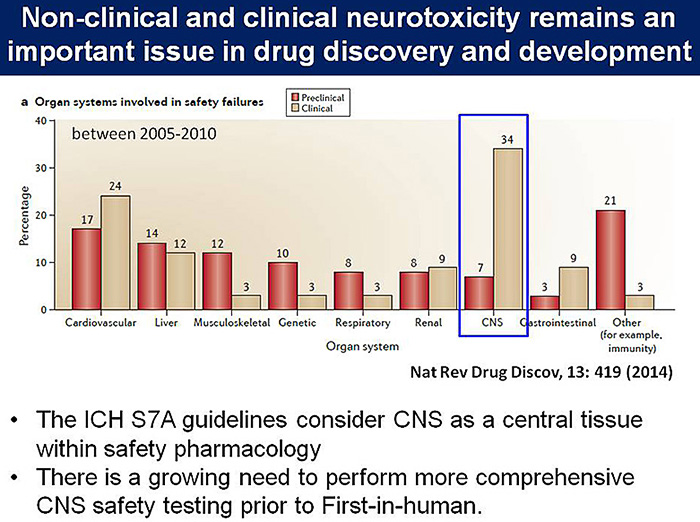
製薬企業の医薬品開発の詳細な解析により,非臨床および臨床における中枢神経系の安全性評価が難しいことが報告されており(図4),ヒトiPS細胞由来神経細胞を用いた安全性薬理試験法の確立が期待される.副作用の中でも,2015年に実施された国際安全性薬理学会の調査において,中枢で生じた痙攣の発生頻度は非臨床・臨床ともに高いことが明らかにされた(4).
このような背景のもと,米国HESIのTranslational Biomarkers of Neurotoxicity委員会・MEAサブチームにおいて,MEA技術を用いた痙攣予測法の開発のために国際検証試験が実施されており,我々薬理部も参加している.現在,多施設で取得されたラット神経細胞およびヒトiPS細胞由来神経細胞のデータを詳細に解析しているが,サンプル間で自発興奮状態にばらつきが大きいこと,培養日数などによりベースラインが変化すること,同期バースト解析のための統一的な閾値の設定が難しいこと,ベースが過興奮のサンプルでは痙攣誘発薬でスパイク数やバースト数が減少してしまうケースも認められることなど,まだまだ課題が山積している.心筋での成功体験をもとに,標準的なプロトコルの作成,痙攣に関する適切なエンドポイントの選定などをさらに検証を進める必要がある.
また,ヒトiPS細胞由来肝細胞に関しても肝毒性の評価などに対する利用が期待されている.特に,ヒト凍結肝細胞の安定供給やロット間差などの課題を克服できる可能性がある.薬理部でヒトiPS細胞由来肝細胞の薬物代謝酵素やトランスポーターの発現など細胞特性を検討しているが,まだまだ分化細胞の性質が未成熟であり,国際的に検証するような状況には至っていない.引き続き,3次元培養や基材など分化誘導技術の検討が必要である.
以上述べてきたように,目的に適った細胞作成技術を開発して,国際連携を図りながら評価法の開発を進めることにより,ヒトiPS細胞技術を非臨床試験に利用する可能性が広がると期待される.
5.終わりに
本総説では,ヒトiPS細胞技術を用いた新しい安全性薬理試験法の構築と国際標準化に向けた日本の取り組みを紹介した.特に,ヒトiPS細胞由来心筋細胞は,医療の場において懸念される薬剤誘発性の致死性不整脈を高精度に予測し,薬物による死亡事故を未然に防ぐための有効なツ-ルであるということが考えられており,現在,ICHガイドラインS7BのQ&Aに関する議論が開始された.iPS心毒性に関する国際標準化の取り組みの経験を生かして,今後,神経や肝臓など他の臓器細胞に関してもヒトiPS細胞由来分化細胞を用いた医薬品安全性試験への利用が期待される.
ヒトiPS細胞技術など新しい科学技術の導入により,より安全で有効な医薬品の開発につながると考えられるが,そのためには評価法の妥当性を示す科学的根拠が必要不可欠である.新しい試験法による安全性評価の蓋然性や,試験法の再現性の高さなどをバリデーションすることにより,新たなガイドラインの制定や改訂などの議論につながり,最終的には被験者や患者の安全性確保をさらに高めることが期待される.日本からイノベーションをもとにした新しい評価法の開発を先駆的に進めて,国際標準化に向けて戦略的に取り組むことが重要である.



