展望
 |
薬物動態研究とDDS研究の合流DIS DDS
|
1995年にFDAはDoxil®を認可し,抗がん剤をリポソームに封入した全身投与型の画期的製剤が臨床で使用されるようになった.平均粒子径約100nmで粒子表面をポリエチレングリコール(PEG)で修飾した血中滞留性リポソームは,ゆっくりと腫瘍の毛細血管を漏れ出して腫瘍組織に蓄積していく.このメカニズムはEPR-効果(Enhanced Permeability and Retention-Effect)と呼ばれ,松村・前田らにより1986年に発見された(Matsumura Y and Maeda H. Cancer Res. 46: 6387-92, 1986).血中滞留性の無いリポソームに封入したDoxorubicinでは,生存曲線が有意に延長するというデータが報告されていたが,血中滞留性リポソームになると,生存曲線は100%に跳ね上がった.このような劇的な抗腫瘍効果が1991年以降続々と報告され,1995年の認可に至り,Doxil®もEPR-効果もナノ粒子を用いたがん治療の金字塔となる.しかしながら,Doxil®以降,ナノ医薬品の臨床における成功例は予想外に少なく,Doxil®は臨床では効かない,という説が浮上し,国際コントロールドリリース学会でも議論となった.2016年6月には,Journal of Controlled Releaseに,Doxil®とfreeのDoxorubicinの抗腫瘍効果を比較したメタ解析が発表された.結果は,非臨床試験ではDoxil®は非常に有効であったが,臨床ではDoxil®はfreeのDoxorubicinと比較して有意差は無かった.EPR-効果はマウスにおける腫瘍モデルにおいて確立された概念であるが,ヒトのがんにおいて果たしてEPR-効果はどの程度機能しているのか,定量的なデータはほとんど無いのが実情と思われる.ヒトにおけるin vivo imagingが行われることにより,この問題も科学的に解明されることになるであろう.
一方で,核酸医薬は抗体医薬に続く次世代医薬品として期待されており,日本の製薬会社も熱い視線を送っている.2017年7月に日本核酸医薬学会第3回年会が札幌で開催された.この学会は日本発の核酸医薬品を創出しよう,という共通の目的を有する人達が集まって生まれた新しい学会で,2015年12月に京都で第1回年会が高倉義信大会長のもとで開催された.学のみならず,産と官のエネルギーに満ち溢れた学会で,核酸医薬品の創出への強い期待感が感じられる.siRNAを搭載した全身投与型の核酸医薬品としてAlnylam社が中心となり進めているPatisiranが現在臨床試験の第3相終了間近で,来年春には認可される予定らしい.この医薬品に用いられているDDSは,British Columbia大学のPieter Cullis教授が原理を考案し,多くの化学者との共同で開発に成功したpH-応答性カチオニック脂質(略称:DLin-MC3-DMA)が用いられている.投与量の9割程度は肝臓に集積し,肝実質細胞で発現している遺伝子を0.005mg siRNA/kgという極微量でサイレンシング可能な超高性能DDSである(M. Jayaraman, et al. Angewandte Chemie 51: 8529-33, 2012).DLin-MC3-DMA は第一世代のDLinDMAから改良に改良を重ねて最適化された第三世代でbreakthrough technologyという名にふさわしい画期的な技術である.飛躍的に投与量を下げることができるようになり,毒性との乖離が可能となり,臨床試験を突破するものと期待されている.来年の春にFDAに認可されれば,DDSを活用した全身投与型核酸医薬の扉が拓かれ,新しい時代に突入すると予想している.
このように,EPR-効果の問題が現れたり,核酸医薬に希望の光が見えたり,DDS領域は今激動の時代を迎えている.一般に低分子医薬の場合,血中濃度を指標として十分な薬効が得られかつ毒性が発現しない有効血中濃度領域という指標が生まれ,実際にコントロールされてきた.何故ならば,薬効を規定する非結合型薬物濃度について,作用部位の薬物濃度と血中濃度が等しい,あるいは,比例関係が存在することを仮定することができたからである.しかしながら,機能性核酸のように作用部位の濃度は,siRNAならば標的細胞の細胞質中の濃度であり,pDNAであれば標的細胞の核内濃度と考えられる.これらの濃度は用いるDDSの性能に大きく依存していて,どのような関係にあるのか不明な場合も多い.
我々はウイルスベクターと非ウイルスベクターの遺伝子発現効率が細胞内素過程のどこで差が生まれるのか定量的に比較検討を行った.図1のように,アデノウイルスベクターはリポフェクタミンという非ウイルスベクターと比較して,1粒子当たりの遺伝子発現効率は数千倍から1万倍程度も効率が良い.この違いは一体どこにあるのか?
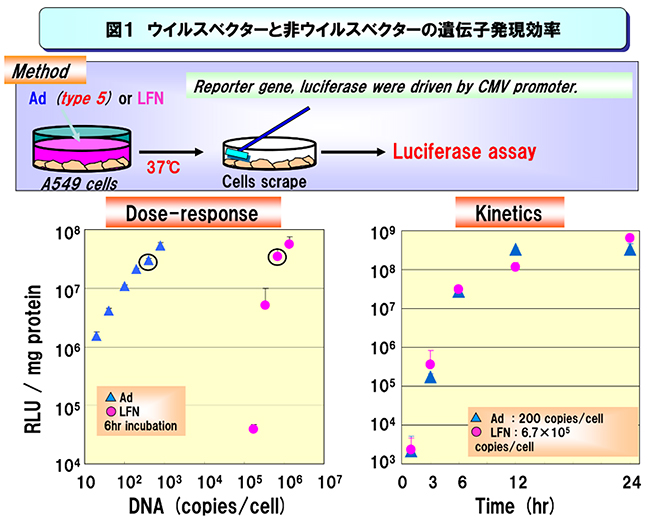
図1 非ウイルスベクター(リポフェクタミンプラス)とウイルスベクター(アデノウイルス)との遺伝子発現活性を比較した.右図は発現のタイムコースを表し,左図は発現のdose-response curveを表している.この結果から,遺伝子発現の速度はほぼ同等であるが,一遺伝子当たりの発現効率はウイルスベクターが数千倍~1万倍も効率が良いことが示唆される.(Molecular Therapy 13(4): 786-794, 2006のデータに基づき改変.)
我々は,1)細胞への取り込み,2)エンドソーム脱出,3)核移行,4)転写発現効率,という素過程に分解し,それぞれに10倍程度の差があり,結果として1万倍の差が生まれているのではないか,と思って研究を始めた.しかしながら,結果は信じがたいものであった.ウイルスベクターの遺伝子発現効率の良さは核までの送達効率の良さにあるのではなく,核内に送達したpDNAの転写・発現効率の良さにある(~8000倍)ことを明らかにした(Akita et al. Molecular Therapy 13(4): 786-794, 2006).
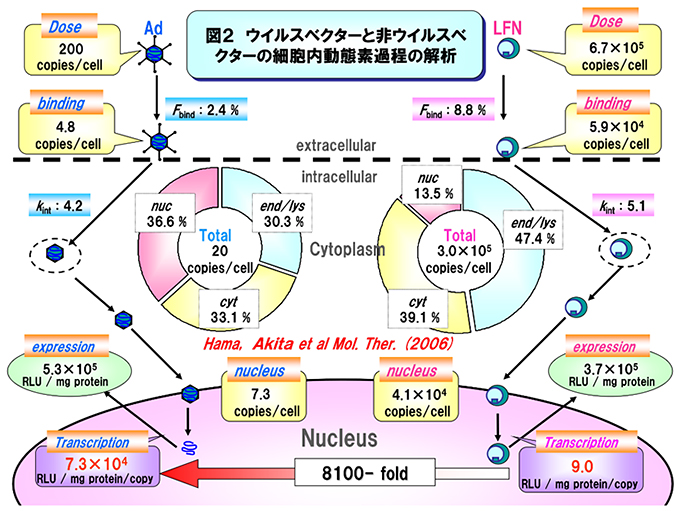
図2 遺伝子発現効率の大きな違いが細胞内動態のいずれの素課程に起因しているのかをまとめた.細胞との結合,内在化,エンドソーム局在,核内移行などの過程に桁違いの相違はなかったが,核に送達した遺伝子当たりの発現効率は,ウイルスベクターが非ウイルスベクターの8000倍も高い効率があることが明らかとなった.(Molecular Therapy 13(4): 786-794, 2006のデータに基づき改変.)
このような結果は低分子薬物のPK/PDとは大きく異なるところであり,DDS研究の未知の領域でありかつ科学的にも興味深いところと思われる.従って,DDS領域では薬効を理解するためには,キャリアーの体内動態と主薬の体内動態の解析はもとより,細胞内動態の定量的解析が不可欠となる.しかしながら,ほとんどのDDS研究者は物創りにエネルギーを費やしていて,細胞内動態の定量的解析はキャパシティーオーバーの状況である.今こそ,動態研究者とDDS研究者が密接に連携することにより,DDSを用いた薬剤の体内動態と細胞内動態を考慮したPK/PD-modelingが期待されている.
日本薬物動態学会は,動態学研究者とDDS研究者が出会い,連携して,新しいDDS・動態研究が展開される絶好の場となることを希望している.
DIS世話人
| 代表世話人 | 原島秀吉 | 北海道大学大学院薬学研究院 薬剤分子設計学研究室・未来創剤学研究室 |
| 世話人 | 高倉喜信 | 京都大学大学院薬学研究科 病態情報薬学 |
| 山下伸二 | 摂南大学薬学部 薬剤学研究室 | |
| 楠原洋之 | 東京大学大学院薬学系研究科 | |
| 石田竜弘 | 徳島大学薬学部 薬物動態制御学 | |
| 中川晋作 | 大阪大学大学院薬学研究科 薬剤学分野 | |
| 加藤くみ子 | 国立医薬品食品衛生研究所 薬品部 |




