技術・研究材料紹介(企業広告)
Corning® HepatoCells スフェロイド: 新規3次元培養毒性試験モデルコーニングインターナショナル株式会社 ライフサイエンス事業部
|
Corning HepatoCellsは当社の独自不死化技術によりヒト初代肝細胞から作製した肝細胞型細胞である.製造施設において同一形質の細胞を増殖させ,出荷前に増殖能を無くした上で初代肝細胞様のシングルユース凍結細胞として供給している.Corningスフェロイドマイクロプレートは超低接着表面(Ultra-Low Attachment)の丸底ウェルにより各ウェル内でシングルスフェロイド形成を促進する.これら二つの技術を組み合わせてHepatoCellsスフェロイドを作製し,3次元(3D)培養モデルの肝毒性試験への適応性を検討した.
方法
HepatoCellsを解凍後,細胞を数えたうえでスフェロイドプレーティング培地に懸濁してCorningスフェロイドプレートに所定の細胞数で播種し,プレートを5%CO2,37℃インキュベーターに入れた.最初の2日間は培地交換を行わずに細胞の凝集を待ち,3日目以降は毎日,既存培地半量を抜いて新規培地を半量加える形でウェル内の培地交換を行った.
HepatoCellsスフェロイドの形成と特性
Figure 1は384ウェルプレート使用時の最適細胞数を決定する目的で,一連の希釈系列で細胞数を振って検討した結果である.1ウェル5,000(5K)未満の播種密度ではシングルスフェロイドを形成するのに2〜3日かかり,それ以上の細胞数ではさらに日数を要した.スフェロイドはほぼ円形の輪郭をもったものが形成された(Figure 1).
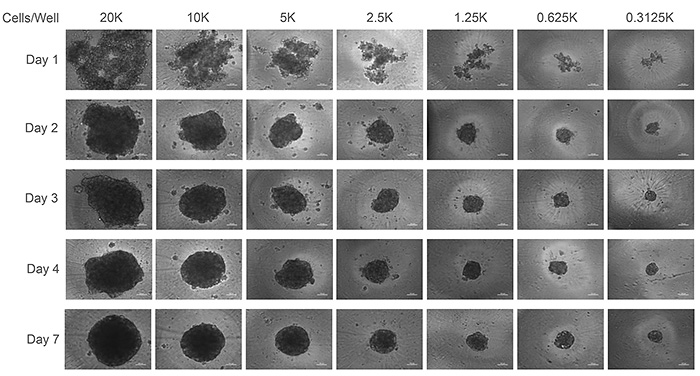
Figure 1. 播種密度とスフェロイドサイズの関係.HepatoCellsをCorning 384ウェルスフェロイドプレート(カタログ番号4516)に播種して7日間培養した.最初の2日間は培地交換は行わず,それ以降は培地の半分を交換した.バーは100μmを示す.
構造と形態を評価するために,7日目のスフェロイドを10%ホルマリンで固定しパラフィン包埋後,切片をヘマトキシリン&エオシン(H&E)染色して顕微鏡観察した.その結果,中心部までネクローシスの兆候を示す細胞は見られず健常な細胞の集団であった(Figure 2).播種細胞数が同じであれば7日目におけるスフェロイド直径はウェル間でほぼ一定で,最初にウェルに入れた細胞数との間に明瞭な相関性を示した.7日目スフェロイドに関してATP-bioluminescent assayを行い,スフェロイドが産生するATPレベルと播種細胞数との間にも良好な相関性が見られた.定量的な評価を行った結果,細胞数が少ない(<5K/ウェル)段階では細胞数とATPレベルの間に非常に高い相関性が見られた.以上の結果から,播種細胞数としては1.5K/ウェルを推奨することとした.
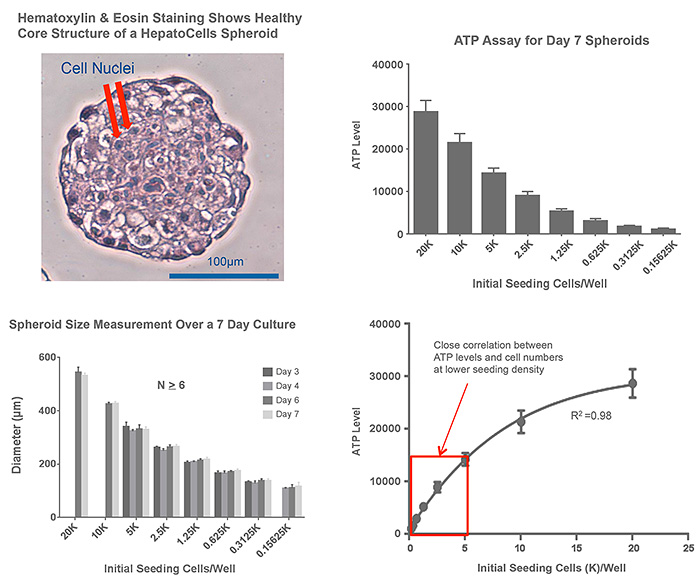
Figure 2. 均質なHepatoCellsスフェロイドの形成.384ウェルスフェロイドプレートにグラフに表示した細胞数で播種した.細胞数1.5Kの培養7日目スフェロイドを取り出し10%ホルマリン含有PBSで24時間以上固定しパラフィン包埋し10μm厚切片とした.スフェロイドサイズを測定したグラフでは,表示した各日時で画像を撮影し寸法を測定した.ATPレベル(バイアビリティ)はPromega社CellTiter-Glo 3D kitにより測定した.
HepatoCellsスフェロイドのCYP3A4活性
HepatoCellsスフェロイド(3D)培養におけるCYP3A4活性をluciferin-IPAプローブを用いた特異的bioluminescentアッセイ(Promega社)により測定し,平板(2D)培養と比較した(Figure 3).両方の培養系で播種してから同じ時間でCYP3A4活性(非誘導のbasal活性)を測定した上でATPレベルに対して補正した.補正したCYP3A4活性は3Dにおいて2Dの538%であった(Figure 3C).またHepatoCellsスフェロイドにおけるCYP3A4活性の誘導性についても検討を行った.Table 1に示すようにスフェロイドをrifampicin(10μM)で3日間処理した時,約3倍の活性上昇がみられた.2D系ではCYP3A4活性誘導は19.6倍であり,それに比べると低いが,これはスフェロイドにおいてCYP3A4 basal活性が上昇したことに由来したと考えられる.
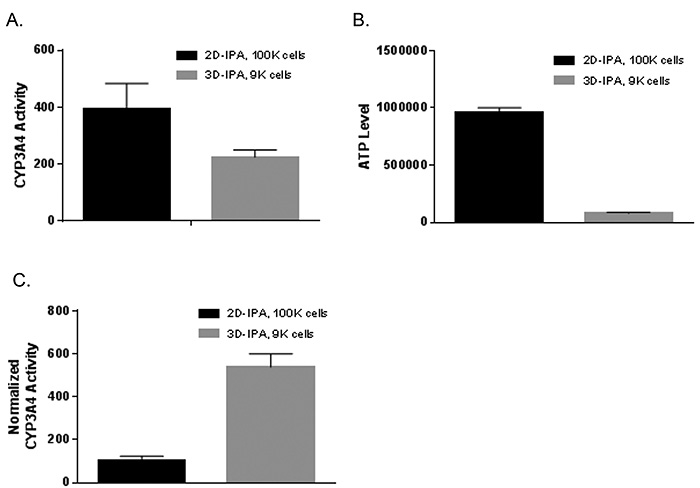
Figure 3. HepatoCellsのスフェロイドでは2D培養に比べCYP3A4活性(ATPレベルでnormalizeした)が上昇していた.HepatoCellsを96ウェルスフェロイドプレートに1.5K/ウェル播種した.併行してHepatoCellsをCorning BioCoat Collagen I 96ウェルプレートに播種して平板接着(2D)培養した.
(A):CYP3A4活性は培養7日目に(スフェロイドは6個をプール(細胞数9K)して,2Dは細胞数100K/ウェル)Promega社Luciferin-IPAキットで測定した.
(B):3D・2D培養系に関してそれぞれ(A)と同じ細胞数で測定したATPレベル.
(C):(A)を(B)で除して補正したCYP3A4活性.エラーバーはn = 3の標準偏差.
| Single Spheroid | 5 Spheroids | |||
|---|---|---|---|---|
| DMSO | RIF | DMSO | RIF | |
| CYP3A4 Activity | 167.1 (n = 5) |
535.7 (n = 4) |
983.9 | 3,483.8 |
| Fold Change | 3.2 | 3.5 | ||
Table 1. HepatoCellsスフェロイドでのCYP3A4活性の誘導.リファンピシン(RIF, 10μM)で3日間の誘導を行った.単一スフェロイドで,又は5スフェロイドを1ウェルに集めて,培養4,5,6日目に10μM RIF含有培地に曝露した.非曝露コントロールとしては0.1% DMSO含有培地を使用した.7日目にLuciferin-IPAプローブ(Promega社)でCYP3A4活性測定を行った.
古典的肝毒性物質の効果
ヒト肝細胞3D培養系は2Dよりin vivo状態に近く,in vitro肝毒性評価系として有望であることが示されている.Corning HepatoCells 2D培養でのaflatoxin B1による肝毒性はCYP活性依存性である.これはCYP阻害剤のketoconazoleによる前処理によりaflatoxin B1の毒性作用が抑制されたことで示された(Figure 4の▼印).一方,3D培養系の場合はaflatoxin B1誘導性肝細胞死の感受性が亢進していた.培養4日目のaflatoxin B1に対するEC50は2Dで78.4μM,3Dで20.7μMであった.これはHepatoCells 3D培養では同じ細胞の2D培養に比べCYP活性が亢進していたことと整合性のとれた結果である.
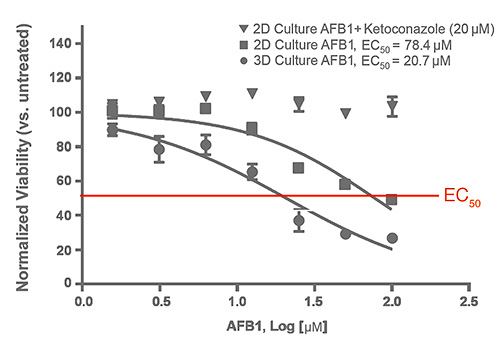
Figure 4. 4日目スフェロイド系と2D系でaflatoxin B1 (AFB1) に対する反応を検討した.HepatoCellsを96ウェルスフェロイドプレートに1.5K/ウェル播種した.2D培養はCorning BioCoatコラーゲンI 96ウェルプレートに100K/ウェル播種して接着状態で培養した.AFB1のグラフ横軸に示す各濃度溶液を調製し,それで各細胞を24時間曝露した.一部の2D培養ではketoconazole (20μM)で2時間予備培養してCYP活性を阻害してからAFB1含有培地を加えた.24時間後にPromega CellTiter-Glo 3D kitでATPレベルを測定しviabilityの指標とした.非処理群でバイオビリティを補正し,Graphpad softwareで非線形回帰分析とEC50値算出を行った.エラーバーはn = 3の標準偏差.
結論
Corning HepatoCellsスフェロイドを用いてハイスループット3D培養系を構築することが可能であった.スフェロイドにおけるCYP3A4活性は2Dに比べ高値であった.3D系におけるCYP3A4活性は2D系に比べかなり亢進しており,さらにその誘導能もfold-inductionは2Dに比べ低下したものの保持されていた.古典的な肝毒性物質であるaflatoxin B1, acetaminophenを用いた検討より,本3D培養系は肝毒性HTS評価系として有用なものであることを示すことができた.
使用したCorning製品:
96ウェルスフェロイドプレート(超低接着表面),(カタログ番号4515),384ウェルスフェロイドプレート(超低接着表面)(カタログ番号4516),HepatoCells(カタログ番号354881),HepatoCells培養培地,(カタログ番号354882,本培地は解凍した細胞の懸濁と播種段階では10% FBSを添加して使用し,3日目以降の培地交換時はFBS無添加で使用した).
