技術・研究材料紹介(企業広告)
P450分子種Phenotypingの新ツール「SILENSOMES™」のご紹介
株式会社ケー・エー・シー
試薬事業部
海老澤 栞
薬物相互作用は,薬物の安全性・薬効発現に大きく影響を及ぼす要因であり,これを予測することは,新薬の開発及び製造販売承認申請に必須の項目となっている.新規薬物候補化合物において,異なる薬物を同時に投与された場合の影響を予測するためには,in vitroでの薬物代謝における主要なシトクロムP450(P450)を特定し,それぞれの寄与率を求める,いわゆるP450分子種のphenotypingと呼ばれる検討が重要である.規制当局(EMA/FDA/PMDA)が薬物相互作用のガイドラインにて推奨しているin vitro試験でも,このP450分子種のphenotypingが必要とされており,各種試験(相関解析,組換えヒトP450(rhP450)を用いた代謝試験及び抗体による阻害もしくは化学物質による阻害)が行われている.
しかし,これらには以下のような問題がある.
- 相関解析では,薬物代謝における各P450分子種の寄与率(fmCYP)を直接的に測定できない.
- rhP450のようなモデルでは,肝代謝プロファイルを完全には代替できない.
- P450分子種に対する抗体や化学物質による阻害では,特異性が低い.
これらの点を克服するため,BIOPREDIC International社は,Servier Laboratories社と共同で,新しいin vitro創薬モデルであるSILENSOMES™を開発した.
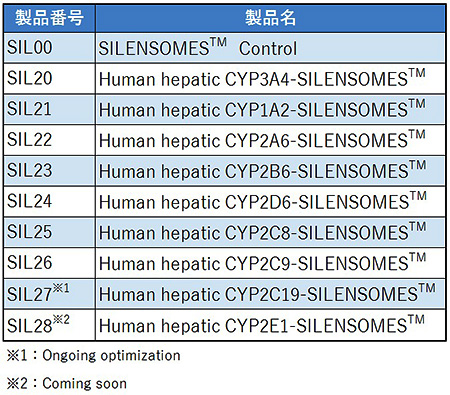
SILENSOMES™は,Mechanism based inhibitors(MBI)を用いて,特定のP450分子種のみを特異的且つ不可逆的に不活化させたヒトプール肝マイクロゾームである.各々のP450分子種に対するSILENSOMES™と,MBIで処理していないヒトプール肝マイクロゾーム(Control SILENSOMES™)が製品化されている(Table.1).この特定のP450分子種に対するSILENSOMES™とControl SILENSOMES™の2つを用いて代謝試験を行い,標的薬物の肝固有クリアランスを比較することで,簡便にfmCYPを求めることができる.また,複数種類(または全種類)のSILENSOMES™とControl SILENSOMES™を組み合わせて使うことにより,複数の異なるP450分子種のfmCYPを同時に求めることが可能である.
Y. Parmentierらは,MBIによる阻害の特異性の検証のため,P450分子種それぞれの典型基質として知られている複数の薬物を用いて,CYP3A4-SILENSOMES™とControl SILENSOMES™における代謝を比較し,CYP3A4-SILENSOMES™における阻害率の算出を行った1).更にその翌年,CYP3A4以外のSILENSOMES™についても,P450分子種それぞれの典型基質である複数の薬物を用いて,各P450分子種の阻害率の算出を行った2).同時に,SILENSOMES™を使用した評価系の正確性の検証のため,CYP1A2-,CYP2B6-,CYP2C8-,CYP2C9-,CYP2D6-及びCYP3A4- SILENSOMES™を用いて算出したfmCYPと,rhP450を使用した系で得られた値との比較を行っ
た2).その結果,SILENSOMES™は,MBIによって特異的に対象のP450分子種が阻害されていることがわかった.また,SILENSOMES™を使用して算出したfmCYPは,従来の試験系で得られる値と同等であり,かつin vivoでの評価で報告されている文献値とも高い相関性を示すことがわかった.以下にその詳細を示す.なお,参考文献1), 2)はopen accessとなっているため,関連図表も含め,自由に閲覧することが可能である.
まず,彼らは,CYP3A4のMBIによる阻害の特異性を検証するため,CYP3A4-SILENSOMES™及びControl SILENSOMES™を用いて,CYP3A4及びその他のP450分子種の典型基質の代謝試験を行い,それぞれのP450分子種の阻害率を算出した.なお,阻害率は,CYP3A4-SILENSOMES™とControl SILENSOMES™の比較において,以下の2つの方法により算出した.
①各P450分子種のKm値に近い基質濃度条件下での初速度からMBIによる阻害の割合を算出する方法
②基質濃度の高い飽和条件下での飽和最大速度VmaxからMBIによる阻害の割合を算出する方法
その結果,CYP3A4-SILENSOMES™は,どちらの方法においても,CYP3A4の基質(nifedipine, testosterone, midazolam)のみ,阻害率80%以上の値を示した.また,②のVmax法において,CYP3A4以外のP450分子種の阻害率はほぼ0%であり,CYP3A4-SILENSOMES™において,CYP3A4以外の基質のVmaxにはMBIによる影響が無いことがわかった.これらのことから,CYP3A4-SILENSOMES™は,CYP3A4以外のP450分子種の活性を維持しており,CYP3A4に特異的な不活化が生じているということが確認できた1).
その後,彼らは,CYP3A4以外のSILENSOMES™を用いて同様の検討を行い,CYP1A2-,CYP2B6-,CYP2C8-及びCYP2C9-SILENSOMES™についても,対象のP450分子種に特異的な不活化が生じていることを確認した2).
次に,20種類の既知の化合物について,in vivoでの評価で報告されているfmCYP(文献値; 計算式1から算出)と,SILENSOMES™を使用して求めたfmCYP(計算式2から算出)の相関を検証した.また,in vivoでの評価で報告されているfmCYPと,rhP450を使用して求めたfmCYP(2種の基質(nifedipine, testosterone)を用いたrelative activity factor法(RAF法)3),4)で算出)の相関も確認し,以下3種類の解析を行った.
- in vivo fmCYP(文献値)vs. SILENSOMES™
- in vivo fmCYP(文献値)vs. rhP450 with nifedipine RAF
- in vivo fmCYP(文献値)vs. rhP450 with testosterone RAF
結果,SILENSOMES™を用いて求めたfmCYPは,その70%が文献値との誤差範囲±15%以内に入った.また,平均二乗誤差に関しても,3つの相関図の中で最も小さい値を示した.これらの結果から,rhP450と比べて,SILENSOMES™がより正確に各P450分子種の寄与率を求められることがわかった2).
計算式1
fmCYP=(1-AUC/AUCi)/(1-ClnonCYP/Clptot)
- AUC
- :血中薬物濃度時間曲線下面積
- AUCi
- :inhibitor添加条件での血中薬物濃度時間曲線下面積
- Clptot
- :静脈内投与後の全身血漿クリアランス
- ClnonCYP
- :P450以外の消失経路を介したクリアランス(未変化体での尿中排泄やnon-P450酵素を介した第Ⅱ相代謝などを含む経路によるクリアランス)
計算式2
fmCYP=(1-ClintSIL/ClintcSIL)×100
- ClintSIL
- :SILENSOMES™で求めた肝固有クリアランス
- ClintcSIL
- :Control SILENSOMES™で求めた肝固有クリアランス
以上のことから,SILENSOMES™は,対象のP450分子種のみ特異的に不活化されており,また,SILENSOMES™を用いた方法は,従来のrhP450を用いた方法に比べて,より正確にin vivoでのfmCYPを算出できることが示された.
現在,SILENSOMES™のラインナップは,CYP1A2,CYP2A6,CYP2B6,CYP2C8,CYP2C9,CYP2D6,CYP3A4の7種となっており,CYP2C19とCYP2E1についても開発が進められている.これらのシリーズを用いることで,P450分子種のphenotypingを行うことができる.従来の試験系でのrhP450からSILENSOMES™への置き換えが可能な上,EMA/FDA/PMDAの薬物相互作用ガイドラインに沿った試験法として,ワンステップで新規薬物候補化合物のP450分子種の寄与率を求めることが可能である.
なお,これまで,Control SILENSOMES™は,各P450分子種毎に調製されていたが,昨年末より,全分子種共通のControlが提供されるようになり,複数のP450分子種の寄与率を同時に見積もる場合に,より簡便に検討を行うことが可能となった.今後,新規薬物候補化合物の薬物代謝への各P450分子種の寄与率を検討する際に,大いに活用できるツールとなると期待される.
参考文献
- Parmentier Y, et al. “Direct and quantitative evaluation of the human CYP3A4 contribution (fm) to drug clearance using the in vitro SILENSOMES model.” Xenobiotica 47 (2017): 562-575.
URL:https://www.tandfonline.com/doi/full/10.1080/00498254.2016.1208854 - Parmentier Y, et al. “Direct and quantitative evaluation of the major human CYP contribution (fmCYP) to drug clearance using the in vitro SILENSOMES™ model.”Xenobiotica (2018): in press.
URL:https://www.tandfonline.com/doi/full/10.1080/00498254.2017.1422156 - Crespi CL, Penman BW. “Use of cDNA-expressed human cytochrome P450 enzymes to study potential drug-drug interactions.” Advances in Pharmacology 43 (1997): 171-188.
- Venkatakrishnan K, von Moltke LL, Greenblatt DJ. “Human cytochromes P450 mediating phenacetin O-deethylation in vitro: Validation of the high affinity component as an index of CYP1A2 activity.” Journal of Pharmaceutical Sciences 87 (1998): 1502-1507.



