展望
 |
Microphysiological System DIS
|
1.Microphysiological System(MPS)の概略
ヒト由来細胞を使ったIn vitro試験は,化合物の代謝安定性や安全性を評価するために用いられております.しかし細胞培養に汎用されるプラスティック培養容器による静置培養は,生体内の環境からの解離が大きいため細胞機能が著しく低下してしまいます.例えば,肝臓は生体内で500を超える機能を有していますが,肝細胞として単離された時点から多くの機能が低下してしまいます*1.このことが,In vitro試験からヒトにおける薬物動態や安全性を予測することを難しくしている一因であります.
MPSの概念は,従来のIn vitro培養が持つ課題を克服していくことで生体内の臓器や臓器間のつながりをIn vitroにおいて再現するものであります.これを実現するためのアプローチを大別すると,細胞自身の機能を高める“細胞の品質”の向上と,生体内の環境を模倣する“細胞の環境”の整備の2つに分けられ,いずれもMPS技術の柱を担っております(図1).
2.MPS技術の創薬への応用と課題
現在,医薬品候補化合物の薬物動態や全身毒性の評価のために実験動物が多く用いられています.しかし,体内動態や毒性発現におけるヒトと実験動物との間の種差は大きく,実験動物に対する愛護の観点からも,実験動物の削減の動きがより一層加速していくことが予想されております.そのため,創薬の現場においても実験動物を用いた試験の代替法としてのMPS技術への期待は大きく,実際に,再生医療技術(iPS細胞等)や3次元培養技術(3D-bioprinting, スフェロイド培養等)を始めとした基盤技術が近年,飛躍的に発展しています.例えば,ヒトiPS由来心筋細胞で構成される細胞塊は,心臓の拍動をIn vitroで再現できるMPS技術であります.このMPS技術は既に創薬の現場においても利用されており,従来のIn vitro試験では難しかった医薬品候補化合物の催不整脈リスクを予測する代替法としての地位を確立しつつあります*2.
一方で,薬物動態において中心的な役割を担う肝臓はその機能の多様性から,生体内での機能をIn vitroにおいて再現するには,依然として解決すべき課題が多くあります*3.そのため肝機能を再現するMPS技術の創薬への応用には,要素技術をいかに組み合わせるかに加えて,そのIn vivoとの相違を理解し,創薬の現場において求められる技術にどのように落とし込んでいけるのかを,産官学が協同して考えていく場を作ることが重要でありMPS DISが担うべき役割であると考えております.
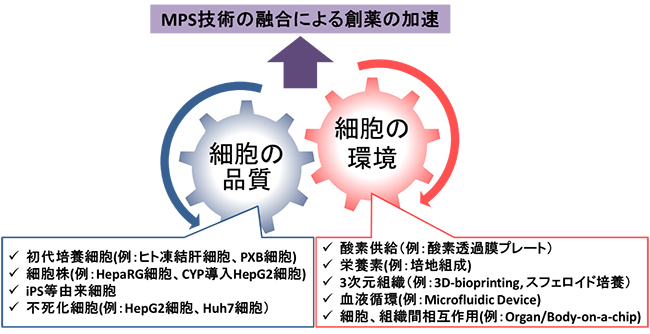
図1 創薬を加速させるMPS技術の融合
3.MPS DISのビジョン
MPS DISは今年度からスタートした新しいDISであります.MPS DISでは「ヒト組織を活用した薬物動態・安全性予測研究について最先端の知見を共有し,Drug Discovery研究におけるDeath valley克服にMPSで何ができるのかを提言していく.」ことを理念として以下のメンバーにて活動しております.
| 氏名 | 所属 | |
|---|---|---|
| 委員長 | 田端健司 | アステラス製薬株式会社 |
| オーガナイザー | 関根秀一 | 千葉大学大学院薬学研究院 |
| 委員 | 水口裕之 | 大阪大学大学院薬学研究科 |
| 登美斉俊 | 慶應義塾大学薬学部 | |
| 平林英樹 | 武田薬品工業株式会社 | |
| 小森高文 | エーザイ株式会社 | |
| 今岡知己 | 第一三共株式会社 | |
| 手塚和宏 | アステラス製薬株式会社 |
4.創薬におけるMPSの活用に関する国内外の動向
国内において,再生医療技術や組織工学等のMPSに関連する基盤研究は盛んに行われており,最先端の技術が多く存在しています.一方で,これら技術の創薬への応用という面では,欧米に後れを取っているのが現状であります.近年,臓器や臓器間ネットワークをチップ内に再現するOrgan/Body-on-a-chip(図2)が,生体内での細胞の振る舞いを再現可能とする革新的なMPS技術として世界的な注目を集めております.米国では,米国国立衛生研究所(NIH)を中心として,Organ/Body-on-a-chipの創薬への応用に向けたプログラム(Tissue Chip for Drug Screening program)が2012年からの5年間で$70 millionの規模で拠出されるなど,その注目の高さがうかがえます*4.国内でも日本医療研究開発機構(AMED)において「創薬基盤推進研究事業*5」や「再生医療の産業化に向けた評価基盤技術開発事業の開発*6」など,薬物動態や安全性の評価手法としてMPS技術の活用を加速していくためのプロジェクトがスタートしています.MPS DISとしても国内外の動向に注視していくと共に,JSSX会員への最新情報のアップデートを続けていきます.

図2 Organ/Body-on-a-chipの概念図
(Lab on a Chip Volume 13 Number 18の表紙をRSC Publishingより許可を得て引用*7)
5.今年のシンポジウムについて
MPSの要素技術の開発は,アカデミア,素材メーカー,バイオテックベンチャーを中心に盛んに行われています.しかし,実際の創薬の現場において,ヒトでの薬物動態や安全性の予測のために求められている技術との間にギャップが存在していることも確かであります.本シンポジウムでは,そのギャップを埋めるために創薬におけるIn vitro試験の課題は何か,どのようなIn vitro試験を求めているかを,製薬企業サイドから提案してもらい,それに応えられる(られそうな)技術について,アカデミアサイドから提案することを意図して,シンポジウムを企画しました.
本シンポジウムでは,Main Topicとして「胆汁排泄クリアランス (+血管へのback flux)の予測」を取り上げ,実際に創薬の現場でサンドイッチ培養肝細胞を用いた薬物動態試験の経験を豊富にお持ちの手塚和宏先生(アステラス製薬株式会社)よりMPS技術の現況や直面する課題についてご発信いただきたいと考えています.それに続き,肝細胞や肝組織の高機能化に関わる最新のご研究を「細胞の品質」の側面から立野知世先生(株式会社フェニックスバイオ),「細胞の環境」の側面からは,須藤亮先生(慶應義塾大学理工学部),松崎典弥先生(大阪大学大学院工学研究科)よりご紹介いただきます.そして特別講演として,本DISメンバーでありiPS由来肝細胞の実用化に成功されている水口裕之先生(大阪大学大学院薬学研究科)より最先端の研究をご紹介いただきたいと考えています.また,胆汁排泄クリアランスの予測のためのIn vitro試験系として必要となる,毛細胆管構造の構築や胆汁排泄の評価のために必要なMPS技術の将来展望や現時点での課題等についてさらに掘り下げるために総合討論の場を設けたいと考えています.
最後に,本News Letterをお読みいただき,多くのJSSX会員の皆様に,MPS技術の薬物動態研究への応用について興味を持っていただければ幸いです.疑問点やご質問などがございましたら本DISまで事前にご連絡いただけますようお願い致します.年会の本シンポジウムの総合討論において取り上げさせていただきたいと思います.(ご意見/ご質問は,MPS DIS 関根秀一 宛ssekine-JSSX-@faculty.chiba-u.jp)
※メールアドレス中の “-JSSX-” はスパム対策のために挿入しています.
ご連絡の際は,お手数ですが “-JSSX-” を削除してください.
Reference
- W. H. Horner Andrews, Liver (Studies in Biology) (1979)
- Ando H, Yoshinaga T, Yamamoto W, Asakura K, Uda T, Taniguchi T, Ojima A, Shinkyo R, Kikuchi K, Osada T, Hayashi S, Kasai C, Miyamoto N, Tashibu H, Yamazaki D, Sugiyama A, Kanda Y, Sawada K, Sekino Y. A new paradigm for drug-induced torsadogenic risk assessment using human iPS cell-derived cardiomyocytes. J Pharmacol Toxicol Methods (2017)
- 花田三四郎,酒井康行 “組織工学的手法を用いた肝組織再構築に関する研究の現状と課題” 生産研究, 60, 147-151 (2008)
- NIH News releases (https://www.nih.gov/news-events/news-releases/nih-funds-development-tissue-chips-help-predict-drug-safety) (2012)
- AMED 公募情報HP (http://www.amed.go.jp/koubo/010220170403.html)
- AMED 公募情報HP (http://www.amed.go.jp/koubo/010120161221.html)
- Seung-A Lee,a Da Yoon No,a Edward Kang,a Jongil Ju,a Dong-Sik Kimb and Sang-Hoon Lee. Spheroid-based three-dimensional liver-on-a-chip to investigate hepatocyte−hepatic stellate cell interactions and flow effects13, 18: 3435−3766 Lab on a Chip




