技術・研究材料紹介(企業広告)
In vitro皮膚透過性試験法
株式会社LSIメディエンス 分析代謝研究部
田﨑健二
I. はじめに
皮膚は,生体を外部環境から保護するという重要な機能を有し,異物を容易に侵入させないための障壁の役目を果たす.しかしながら,化合物によっては,その物理化学的特性により,その幾分かが皮膚を透過することがある.このことから,局所適用を目的とした医薬品だけでなく,投与経路の一つとして経皮吸収剤を選択するという応用が可能となっている.経皮からの吸収効率を上げるために透過促進剤を利用するような製剤化の工夫も行われている.一方,皮膚を介した暴露という観点から,化学物質の毒性評価のために経皮吸収の評価が要求されるケースもある.ここでは,経皮吸収の評価系の一つであるin vitro皮膚透過性試験について紹介する.
II. In vitro皮膚透過性試験
In vitroで評価した皮膚透過量がin vivoでの経皮吸収率とよく相関することが知られている.そのため,以下のようなことを目的として,in vitro皮膚透過性試験が実施される.
① 化学物質の全身暴露量の推定
② 適切な皮膚内動態を有した製剤化の検討
③ 経皮吸収剤の同等性評価
本試験系はin vitroの評価系であることから,動物実験代替試験法としても用いられている.In vivoでは評価できないヒト皮膚での吸収予測(皮膚への分布率など)も評価することが可能となる.また,複数の剤形を同一個体の皮膚で比較評価することも可能である.

図1 静的拡散セル(Franzセル)
<種の選択>
用いる皮膚はヒトが第一選択とされている.当社では,非営利特定団体エイチ・エー・ビー研究機構を通じて米国National Disease Research Interchange(NDRI)から供給されたヒト皮膚組織を入手するか,もしくは,海外で採取された皮膚組織片を国内代理店を介して供給を受けている.また,試験の目的に応じて,実験動物(マウス,ラット,ブタ)を用いることができ,ヘアレスマウスやブタ耳の皮膚が汎用されている.
<透過セル>
OECDガイドライン428によると,静的拡散セルでもフロー型の拡散セルでも使用できることになっている.当社では,[図1]に示すような静的拡散セル(Franzセル)を使用している.
<レセプター液>
リザーバー側のレセプター液には,pH 7.4の等張液が推奨されており,通常はPBSを用いている.レセプター液は皮膚のバリア機能に影響を及ぼしてはならない.レセプター液への溶解性が不良,吸着性が高いなどの問題が懸念される場合には,皮膚への影響が少ない溶解補助剤や吸着防止剤をレセプター液に添加する.また,有機溶媒は影響を及ぼす可能性が高いので用いていない.
<皮膚切片の準備>
透過の評価に関しては,凍結品の皮膚であっても問題はない.脂肪層を除去した皮膚を透過性実験で使用する.厚さは1 mmを超えないことが望ましいとされていることから,ヒト皮膚の場合には,full-thickness skinではなく,ダーマトームを用いて適度な厚さに調整している.このときのsplit-thickness skinは表皮層と真皮層を含む.また,加熱処理により真皮層を剥がし,表皮膜を作製する方法も報告されている.
なお,真皮層側は,透過性実験の間,常にレセプター液に晒される状態となることから,剥離した皮膚をそのまま透過セルに装着すると,透過実験中に皮膚の状態が変化することで透過プロファイルに影響する懸念がある.そのため,採取した皮膚切片を生理食塩液に30分程度浮かべておき,水分がある程度浸透した後に,余分な水分を除去してから使用する.
<被験薬>
マスバランスを評価するためには放射性標識体の被験薬を用いることが望ましい.しかしながら,製剤化されているような被験薬は,標識体ではないことが多く,その場合には,測定対象となるマトリックスにおける薬物濃度は,バリデートされた分析方法に基づいて測定する必要がある.
<適用製剤の調製及び適用>
既に製剤化されている場合にはそのまま皮膚に適用する.レセプター液が接触している部位のみが透過に作用するので,製剤サイズに留意する必要がある.原薬の場合には,水溶液や懸濁液,軟膏剤などを調製して使用することができる.各試験法ガイドラインによると,適用量は,finite系(経時的に適用濃度が減少するような系)の試験の場合には,~10 µL/cm2とするよう記載されている.
<透過実験法>
静的拡散セル(Franzセル)を使用する場合,角質層がドナー側,真皮層がリザーバー側となるように,皮膚を透過セルに装着する.リザーバー側はレセプター液で満たす.気泡が入ると透過性に影響するので,必ず除去する.レセプター液へ透過した薬剤が拡散するように,撹拌子を入れるが,その間でも気泡が生じることがあるので,レセプター液は脱気しておいたほうがよい.
ドナー側に薬剤を適用し,通常,皮膚の表面温度とされる32℃にて,また,乾燥しないように湿度も維持できる環境で透過実験を実施する.
透過量推移を評価するために,採取孔から経時的にレセプター液を採取する.通常は,レセプター液の容量の10%未満となるような採取量にして,サンプリングが透過に及ぼす影響を最小化する.採取した液量と同じ量の新しいレセプター液を補充する.これらの操作のときにも気泡が入らないように注意する.
透過性実験は通常24時間で終了するが,化合物の特性に合わせて変更してもよい.透過プロファイルの評価の際には,レセプター液の採取のみでよいが,皮膚中の分布やマスバランスを評価する場合には,適用後の製剤,角質層,皮膚,洗浄液などを採取し,それぞれ濃度を測定する.なお,角質層の採取は,通常,テープストリッピング法を用いる.
<皮膚のintegrityの確認>
In vitro皮膚透過性試験において,皮膚の状態が不良だと過剰な透過量を示し,適切な評価ができなくなる.そこで,integrityの確認が各ガイドラインで求められている.
経表皮水分蒸散量(TEWL),電気抵抗(ER),トリチウム水透過などの放射能を指標とする方法がある.テープストリッピングにより作製した損傷皮膚モデルと正常皮膚を用いて薬剤の透過性を比較した場合,[図2]に示すように,トリチウム水の透過量が増大するとともに,薬剤の透過量が増大する.このことから,トリチウム水の透過率は皮膚のバリア機能の指標となっていること,また,バリア機能が失われると薬剤の透過が亢進することが示された.
III. おわりに
当社では,さまざまな投与経路での薬物の動態,薬効,安全性評価を行っており,経皮投与,吸入投与などの特殊な投与経路についても長年にわたり取り組んできた.今回ご紹介したin vitro皮膚透過性試験についても,新規化合物の安全性評価や,新薬開発など様々な場面で,ニーズに即応した試験デザインにて信頼性の高いデータを提供することで,お客様のお力になれば幸いである.
参考文献
- OECD, 2003. OECD Guideline for the Testing of Chemicals, No. 428: Skin Absorption: In Vitro Method. Organization for Economic Co-operation and Development, Paris.
- 厚生労働省,局所皮膚適用製剤(半固形製剤及び貼付剤)の処方変更のための生物学的同等性試験ガイドラインについて,平成22年11月1日 薬食審査発1101第1号
- SCCS, 2012. The SCCS’s Notes of Guidance for the Testing of Cosmetic Ingredients and their Safety Evaluation, 8th Revision. Scientific Committee on Consumer Safety
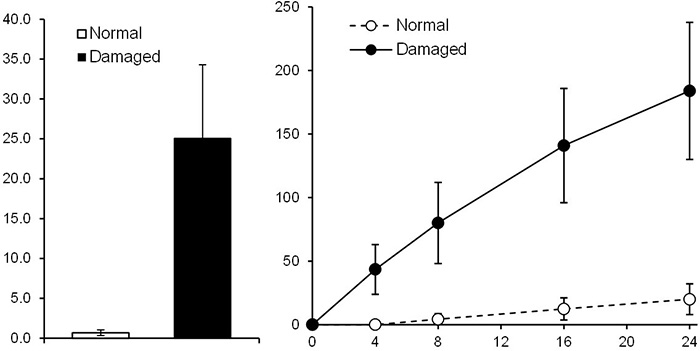
図2 正常皮膚と損傷皮膚での薬物透過の比較
(左)トリチウム水の透過係数(Kp,× 10-3 cm/h)
(右)化合物Xの累積透過量(µg/cm2)の経時的推移
