アドメサークル
 |
日本の薬物動態研究組織(10)
|
個人と組織間の相克
研究を生業とする人間であるなら,誰しも世の中をあっと言わせるような大発見あるいは発明をすることを一度は夢見ると思う.現実となる可能性は限りなく低いとしても,こうした夢を持つことは企業の研究者であっても普通であり,かつ健全なものである.ただ,大学であれ企業であれ,まったくの新人が,最初から面白い研究をしたいと宣言しても笑われるだけであろう.逆に,それでは何でも良いから世間の注目を集めるようなすごい研究を今すぐやれ,と言われたら途方に暮れてしまうのが落ちである.特に若い研究者は,まずは所属する研究グループの目標に向かって地道にテーマを前進させていくことが求められる.ましてや,企業の場合は,組織としての目標が最優先される.個人的な興味の追及は時間と研究費の無駄遣いと取られてしまう.それでは企業の研究所では,いわゆる研究の面白さや楽しさを味わうことができないのであろうか.自分の経験から言えば,「いや,できる!」となる.このことは次節で多少詳しく述べるが,その前に,製薬企業の研究者にとって,新薬の創製プロセスに関わることは喜びの一つであることを改めて強調しておきたい.新しい薬が世に出れば,全世界で百万人以上の患者に福音をもたらすことになる.医者ではないので患者一人ひとりの顔を見ることはできないものの,ベンチワークで汗をかいてきた結果が,多くの人のためになっていることを実感できることは大きな励みとなる.現実的なところでは会社の好業績はいずれ給料にも反映される.こうした達成感が得られることは企業の研究者の特権とも言えるだろう.最近の創薬科学は,ますますシステミックで総合的な科学へと拡大・発展してきている.一昔前のように少数の天才達のインスピレーションで薬ができる時代ではなくなり,創薬は多方面の専門家達による協同作業の様相を呈してきている.従って,人によって濃淡はあるが,「この薬は私が創った」と言うのは多少ともおこがましく,「この薬の○○(例えば薬物動態)に関しては私が担当した」と言うべきものになってきている.創薬研究といえども,企業経営の視点では社員総がかりの製品開発の一部分であり,個人の努力は全体の成果という大海に薄められてしまうのである.その代り,首尾よく新薬が上市されるとプロジェクトに関わった人々は,まとめて社内表彰される.ただ,プロジェクトの顔として特別視されるキーパーソンはどのプロジェクトにも存在し,開発初期において基本特許の取得に努力した探索研究分野の研究者がその役割を果たしていることが多い.野球に例えれば,チームの勝利に9人のメンバーはそれぞれのポジションで申し分のない働きをしたのであるが,それはとりあえず当然のものとして,試合終了後にお立ち台でインタビューを受けるのは,中でも目立ったプレーをした一人か二人になる.他のメンバーもチームの勝利は最重要課題であり,不満があるわけではない.負け試合ではインタビューどころかファンにブーイングを受けてしまうからである.企業の中にブーイングをするファンなどはいないが,会社の業績が思わしくない時になかなか新薬が出ないと,たちまち営業部門などから研究所に対して非難の声があがるのはどこの製薬会社でも同じである.なにしろ,研究所は予算の大部分を食いつぶしている金食い虫であり,常に結果を求められているつらい部署なのである.
企業でこそできる研究
医薬品の開発研究は,けっしてデータ取りだけを目的とした単純作業には終わらない.通常のルーチンワークを実施している中でも,薬物動態学的に興味深い現象にたびたび遭遇する.額に汗して泥臭く仕事をやるタイプの人が「アレッ?」と気づくことが多い.また,開発中の化合物について特有なものなので製薬企業でなければ発見することが難しい.いずれ新薬としての承認申請をすることを考えれば,その現象を詳しく調べておく必要があり,結局,論文もいくつか書くことになる.これは最終的に学位取得に繋がっていく.過去において新薬が1つできると学位取得者が1~2名誕生することを経験してきたが,この事実は,とりもなおさずルーチンワークの中にも興味深い研究的テーマがいくつも転がっていることを示している.こうした興味深い現象をそのまま放置しておいても承認申請に負の影響をあまり与えないことが多い.承認申請データについては,薬物動態試験ガイドラインに記載されている試験項目を現在の科学レベルで追及できる範囲で実施することになっており,それ以上のことを強制されているわけではない.しかし,私はこのような問題には積極的に取り組んだ方が良いと考えている.いずれ薬として承認されて世の中に出ていくものであるのなら,その薬に関してやれることはやっておくのが製薬企業の務めと考えるからである.場合によっては,類薬との差別化につながり,企業としてもメリットのあるデータが得られることもある.
過去,熱意に満ちた若き同僚と共に,私が経験した事例をいくつか紹介したい(各人の名前は引用文献をご覧頂きたい).アンジオテンシンIIブロッカーのプロドラッグであるオルメサルタンメドキソミルは,このクラスの薬物の中では活性体への変換が際立って速く,この代謝反応にはアリルエステラーゼに加えて,なんと,アルブミンが一部,関与していることが確認された(図1)1).
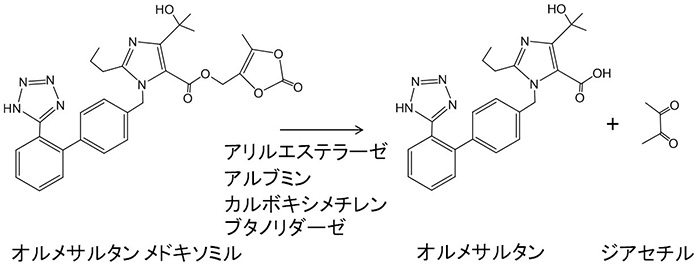
図1 オルメサルタン メドキソミルの代謝経路
(図1 オルメサルタン メドキソミルの代謝経路)
さらなる活性化酵素の追及により,カルボキシメチレンブタノリダーゼというあまり良く知られていない加水分解酵素も活性化に関与していることが確認された2).単純に,プロドラッグ活性化すなわちカルボキシルエステラーゼではなかったのである.先人の慧眼と努力に敬服するしかないのであるが,アルブミンがエステラーゼ活性を有していることは既に報告されていた3).ただ,実際の医薬品が基質となる例としては最初のものであった.
プラウノトールはタイの薬用植物(plau noi)から抽出されたテルペノイド構造を有する抗潰瘍薬である.ラットではβ-酸化を中心に広範な代謝を受け,投与量の大部分が胆汁中にグルクロン酸抱合体として排泄された.アグリコン部分を調べるために胆汁をβ-グルクロニダーゼ処理すると二次元TLC上で多数のスポットが出現し,しかもこれらは親化合物のプラウノトールよりも脂溶性が高かった.グルクロン酸抱合を受ける前に,一旦,脂溶性が高まる代謝を受けていることが示唆され,いわゆる薬物代謝の一般則(第一相代謝と第二相代謝により段階的に水溶性が増して体外に排泄される)に合わない代謝を受けているらしかった.詳細な検討の結果,オレイン酸やステアリン酸などによる脂肪酸抱合を受けていることが確認された(図2)4).
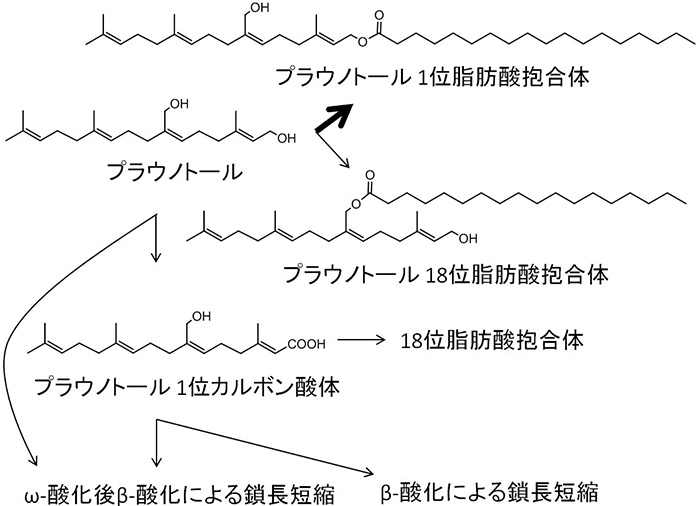
図2 プラウノトールの脂肪酸抱合
脂肪酸抱合は自然界には特に珍しいものではなく,高級アルコールの脂肪酸エステルは,いわゆる蝋として,植物では昔から知られている.また,動物でもコレステロールが脂肪酸エステルになることが知られている.異物に関してもエトフェナメート,DDTの代謝物およびテトラヒドロカンナビオールが脂肪酸抱合されることが報告されており,脂肪酸抱合が特殊な抱合反応として薬物代謝の一角を構成していることが示された.
水溶性がさらに増大する代謝反応も発見された.ある化合物が水酸化され,その単一の水酸基が2回続けてグルクロン酸抱合を受けていたのである.この代謝反応はイヌで認められた.開発進行中の化合物であったので,その代替物質としてヒドロキシビフェニル(フェニルフェノール)を基質として実験を行ったところ,イヌ肝臓ミクロソームを用いた時のみにこの代謝反応が進行した(図3)5).
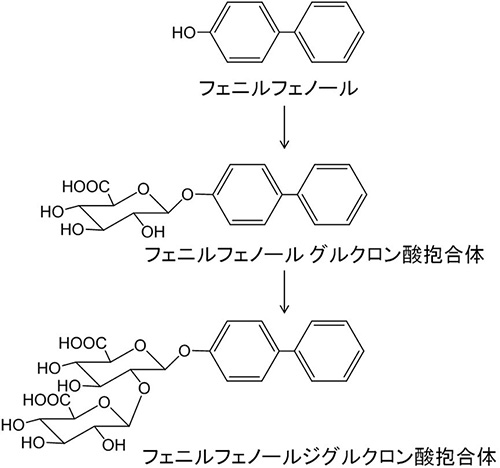
図3 フェニルフェノール ジグルクロニドの生成
珍しい抱合代謝反応であったが,その生理学的意義は不明である.イヌ特異的な反応なのかも知れず,ナルメフェンのジグルクロニドがイヌで生じることが既に報告されていた6).しかし,基質をステロイドに代えてみると,ジヒドロテストステロン(DHT)がヒトおよびサル肝ミクロソームでもジグルクロニドに代謝され,遺伝子発現系を用いた実験では,UGT1A8が関与していることが確認された(図4)7).
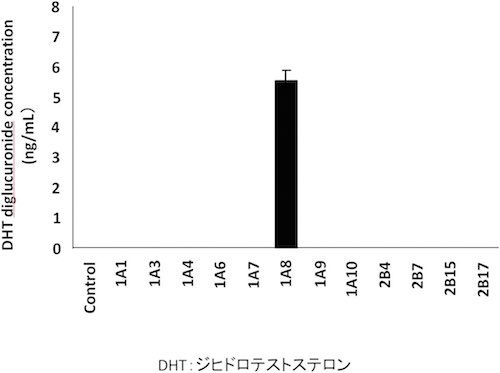
図4 UGT発現系によるジヒドロテストステロン ジグルクロニドの生成
チエノピリジン系抗血小板薬(チクロピジン,クロピドグレル,プラスグレル)はプロドラッグである.チクロピジンとクロピドグレルの薬理活性化メカニズムは長い間不明であったが,プラスグレルについて活性代謝物に至る経路と関与する酵素を明らかにすることができた8).最終的には3種の薬物についてほぼ共通したメカニズムであることが判明した(図5).
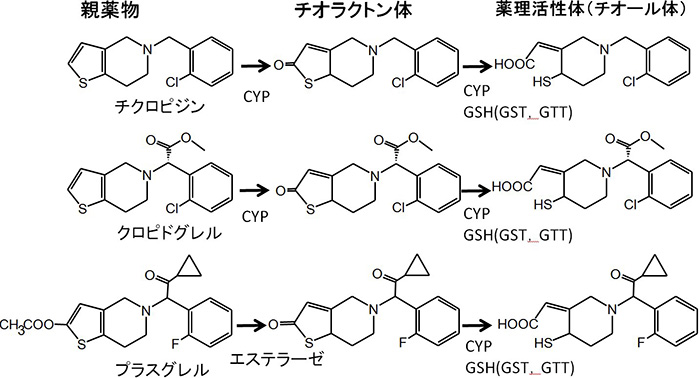
図5 チエノピリジン系抗血小板薬の薬理活性代謝物生成経路
チクロピジンとクロピドグレルでは活性化にCYPによる代謝反応が2回必要であるのに対し,プラスグレルでは1回であり(最初の代謝は加水分解),このことが他剤と比べて臨床用量が10倍近く低いことと薬効発現における個体差が小さいことの理由であることが示された.ところで,薬理活性代謝物の構造が,なぜ40年近くも分からなかったのであろうか?そこには,自然のたくまざる罠が仕組まれていたのである.図5に示すごとく,薬理活性体の前駆物質はいずれもチオラクトン型代謝物である.有機化学的には,チオラクトン環が単純に加水分解されれば薬理活性体となる(我々も最初はそう思っていた).一方で,in vivo系ではチオラクトン体がCYPによって活性化されるというデータが集積されていたので,「加水分解産物のチオール型の代謝物」は薬理活性体ではないと早合点されてしまっていたからであった.実際,チクロピジンとクロピドグレルの開発に貢献されたサノフィー社のP.Savi博士が,チオール体が薬理活性体である,という我々の考えを否定すべく,「チオール体はチオラクトン体の加水分解産物だろう?」と私に質問されたことを覚えている.詳細は省略するが,現実には加水分解ではなく,CYPとグルタチオンにより薬理活性体が生じていたのである.グルタチオンに関わる酵素はGSTとグルタチオンチオール転移酵素(GTT)の2種類で,後者はGSTの働きで生じたS-S結合にもう一分子のグルタチオンを作用させ,遊離のSH基を持つ活性代謝物を生成する.
薬物動態研究所の存在理由
製薬企業の研究所は,探索部門であれ開発部門であれ,必要性があるからこそ存在する.創薬プロセスを円滑に進めるために,その時代の考え方に従って改組を繰り返し,変遷しながら今に至っている.薬物動態研究所も,ほぼ半世紀ほど前のスタート時には,いわゆるADMEデータ収集のために発足した.しかし,多くの委託試験会社が存在する現在では,ルーチンワーク的な薬物動態試験の大部分が外部委託されるようになってきたのは御存知のとおりである.そして,最近では探索試験段階における化合物選択のために薬物動態研究所の人的資源が注ぎ込まれている.少し前には,たとえば膜透過性のin vitro試験にどのような試験系が良いのか,化合物選択のための判断基準をどのレベルに設定すべきかなどが盛んに議論された.現在でもいろいろなdrug-likenessに関する試験法が新たに導入され,その方法の妥当性について活発に議論されていると思う.しかし,近い将来にはこうした探索段階での薬物動態的スクリーニングも成熟したものとなり,外部委託されるようになるであろう.現に,各製薬会社の動向を見ているとその傾向が認められる.探索研究と開発研究の両方の段階で薬物動態試験が外部委託されるようになったら,薬物動態研究所の存在理由がなくなってしまうのではないだろうか?そう危惧するのは,私だけではないと思う.
コア コンピテンシー(Core Competency)
企業合併が盛んに行われはじめた頃,コアコンピテンシーという言葉がはやったことを覚えている方も多いだろう.Coreは「中核となる」あるいは「中心となる」の意味であり,Competencyは「競争力」あるいは「有能さ」の意味である.「中核技術」と訳されていることが多い.これは企業に対する重要な評価項目の一つとなっている.どんな企業であれ,長年培ってきた中核技術をもって世の中で競争し,生き延びて来ているのである.これだけであれば,コアコンピテンシーは別段,人々に危害を加えるものでもない.しかし,英語表現で目くらまししているものの,この言葉には米国に端を発する,冷徹かつ非情なたくらみが秘められている.肥大化してしまった企業が,不要な部門をお役御免とする際の判断基準は,その企業のコアコンピテンシーである.これに関わりがないと判断されれば,その部門は容赦なく切り捨てられてしまうのである.製薬企業のコアコンピテンシーはもちろん,新薬の創製に関わる多様な技術になる.新薬創製の目的で,薬物動態研究所は,最近では探索研究段階で重要な働きをしてきたと言えるのであるが,必要なデータが外部委託で入手できるのなら,社内に薬物動態部門を置かなくても良くなってしまうであろう.私はこの考え方を100%支持するものではないが,欧米流の経営手法に染まった上層部が決断を下してしまったら後の祭りになってしまう.とりわけ企業合併時には,人員削減も一つの目標であるため,切り捨ての圧力は格段に高まる.そのような事態になる前に,あらゆる知恵を絞って薬物動態研究の必要性を訴えるしかない.新たな技術やコンセプト,新規の応用分野,他分野との連携などあらん限りの可能性を探っていく必要があるだろう.コアコンピテンシーの考え方は企業のみならず個人に対してもあてはまる.今,与えられている試験を実施することは当然の義務であるとしても,どっぷりと日常性に埋没していては非常に危うい.常に創造的なテーマに目を向け,自己研鑽を継続していかなくてはならないと気付いているべきである.それでは,一体,具体的に何をやれば良いのか?残念ながら,これに対する完全なる答えを私は持っていない.過去の経験からすれば,新規drug-likenessスクリーニング法の開発,ヒトにおける薬物動態,ひいては薬効・毒性を予測する方法の開発(特異体質性毒性も含め毒性については将来とも重要な関心事),モデリング&シミュレーション,ファーマコメトリクスなど濃度データを生物活性データに読み替える種々手法の開発,複雑な薬物相互作用の予測と回避法,未だに十分ではない個人化医療を具体的に進めること,などなどが重要なものとして挙げられる.あくまで,これらは過去の経験から言えることである.最近の薬物動態学会のワークショップや学術年会ならびに関連学会の色々なシンポジウムテーマを見ると,私の想像を超える目新しいものがいくつも見受けられる.全てのものを完全にフォローすることは難しいしその必要性もないであろうが,少しでも自分のやっていることに関連するものなら積極的に取り入れ,現在の仕事を発展的に進めていく努力をすることを薦めたい.
おわりに
もう10年ほど前に開催された薬物動態学会第18回ワークショップにおいて,英国Pharmaceutical Profiles社のDr. I. WildingがMicrodosingの有用性を詳細に解説された.彼は,講演の最後に進化論で有名なCharles Darwinの言葉:「生き残ることができる生物種は,もっとも強い種や知性に富んでいる種ではなく,もっとも変化に対応できる種である」を引用し,企業合併が続いている現在の製薬会社にとって,これほど適切な言葉はない,と締めくくられたのを今でも覚えている.合併に伴い人員削減が行われていることを考えれば,研究所の人々にとっても気にすべき警句となっている.しかし,研究者にとっては一つのことに集中して継続していくことも大切な要素である.継続と集中によって築き上げられたバックグラウンドがあって初めて,研究を力強く前進させられる面もある.やたら色々なことに興味を示していたのでは根無し草となってしまい,深く掘り下げた研究をすることは難しい.確かに,現代では「継続」と「変化」という矛盾した考え方が両方とも重要なのであろうが,バランスを取るのであれば,やはり「継続」を優先し,日常性に埋没してしまうことを戒めるために「変化」にも常に目を向け,将来を見越して自己研鑽に励んでいる,というのが肝要なのであろう.
引用文献
-
Ma, S.F., Anraku, M., Iwao, Y., Yamasaki, K., Kragh-Hansen, U., Yamaotsu, N., Hirono, S., Ikeda, T., and Otagiri, M.: Hydrolysis of angiotensin II receptor blocker prodrug olmesartan medoxomil by human serum albumin and identification of its catalytic active sites. Drug Metab Dispos., 33: 1911-1919 (2005).
-
Ishizuka, T., Fujimori, I., Kato, M., Noji-Sakikawa, C., Saito, M., Yoshigae, Y., Kubota, K., Kurihara, A., Izumi, T., Ikeda, T., Okazaki, O.,: Human carboxymethylenebutenolidase as a bioactivating hydrolase of olmesartan medoxomil in liver and intestine. J Biol Chem., 285: 11892-11902 (2010).
-
Kurono, Y., Maki, T., Yotsuyanagi, T., and Ikeda, K.,: Esterase-like activity of human serum albumin: structure-activity relationships for the reactions with phenyl acetates and p-nitrophenyl esters. Chem Pharm Bull., 27:2781-2786 (1979).
-
Ikeda, T., Horiguchi, M., Shimizu, K., Mori, I., Yamamura, N., and Komai, T.: Identification of fatty acid conjugates of plaunotol, a new anti-ulcer agent, formed in rat liver homogenate system. Chem Pharm Bull ., 36: 3595-3603 (1988).
-
Murai, T., Tsuruta, F., Terao, T., Ikeda, T., and Iwabuchi, H.: Formation of a structurally novel, serial diglucuronide of 4-hydroxybiphenyl by further glucuronidation of a monoglucuronide in dog liver microsomes. Drug Metab Pharmacokinet., 17:457- 466 (2002) .
-
Dixon, R., Hsiao, J., Hsu, H.B., Smulkowski, M., Tze-Ming-Chan, Pramanik, B., and Morton, J.: Isolation of a novel morphinan 3-O-diglucuronide metabolite from dog urine. Pharm Res (NY) ., 6:28–32 (1989).
-
Murai, T., Samata, N., Iwabuchi, H., and Ikeda, T.: Human UDP-glucuronosyltransferase, UGT1A8, glucuronidates dihydrotestosterone to a monoglucuronide and further to a structurally novel diglucuronide. Drug Metab Dispos., 34:1102-1108 (2006).
-
Hagihara, K., Kazui, M., Kurihara, A., Iwabuchi, H., Ishikawa, M., Kobayashi. H., Tanaka, N., Okazaki, O., Farid, N.A., and Ikeda, T.: Biotransformation of prasugrel, a novel thienopyridine antiplatelet agent, to the pharmacologically active metabolite. Drug Metab Dispos., 38:898-904 (2010).
