受賞者からのコメント
 |
奨励賞を受賞して長崎大学大学院医歯薬学総合研究科(薬学系)
|
この度,「PETを基盤としたニューモダリティの薬物動態研究と画像診断薬・DDS開発への展開」という題目で奨励賞を賜りました.大変光栄であると同時に,身が引き締まる思いです.ご推薦いただきました長崎大学大学院教授の川上 茂先生をはじめ,多くのご指導を賜りました,京都大学特定教授・名誉教授の橋田 充先生,理化学研究所名誉研究員(神戸大学大学院特命教授,大阪公立大学名誉教授)の渡辺恭良先生に深謝いたしております.また,選考委員やご関係の先生方に深くお礼申し上げます.以下,私の進めて参りました研究について,簡単ではありますが紹介させていただきます.
Positron emission tomography (PET)は,代謝トレーサー[18F]fluorodeoxyglucose(FDG)をはじめとする幾つかの分子プローブの普及に伴って,がんや認知症,脳機能の画像診断モダリティの一つとして汎用されています.齧歯類からヒトまでシームレスに活用できるイメージングモダリティであり,特に,ポジトロン放出核種の性質を活かした特徴的な計測原理ゆえに定量性や時間分解能が高いことが特長です.用途を拡張し,創薬・医療の様々な場面での活用が期待されています.
私は,PETを主とする分子イメージング研究に従事し,特に,近年のモダリティの急速な拡張に対応しながら,薬物動態研究への応用やプレシジョン画像診断薬開発を推進して来ました.また,こうした研究には特別な施設や研究環境が必要不可欠ですが,AMED創薬基盤推進研究事業や次世代がん医療加速化研究事業に代表者や分担者として参画し,予算措置を得て最新の動物用PET/CT装置を導入するなど,長崎大学と理化学研究所において,PET動態研究・ラジオセラノスティクス開発のためのファシリティを整備して参りました.これらファシリティを利用したアカデミアや製薬企業の皆様との共同研究は,PET動態研究の有用性の理解を深め,創薬プロセスでの利用促進の一助となっているものと考えております.
1)PETを用いたニューモダリティの薬物動態研究
PETを用いた動態研究は注目を集め,様々な前臨床・臨床研究が行われています.従来不可能であったヒトでの組織中薬物濃度の直接的な評価が可能になったことは薬物動態研究において大きなブレイクスルーとなりました.例えば,薬物トランスポーターを介した薬物動態の非線形現象や薬物間相互作用などが,薬物動態の可視化によってヒトで直接実証されました.これまで,その対象は主に低分子や抗体医薬でした.私は,これを核酸医薬,中分子医薬,光線力学的療法用剤,ナノ粒子DDS製剤,細胞外小胞(エクソソーム)製剤,生菌製剤などの近年注目されるニューモダリティに大きく拡張して参りました1).PETではポジトロン放出核種による標識がまず重要です.短い放射性崩壊半減期に適した標識反応や精製,放射線の影響による分解を防ぐこと,複雑なニューモダリティの構造や性質を保持することが課題でしたが,最小限の化学修飾かつ短縮化した方法をモダリティごとに考案し解決してきました.高い定量性や時間分解能のPET動態データを取得し,integration plot解析などの動態解析手法と組み合わせて,例えば,小型細胞外小胞(エクソソーム)の組織取り込みにおける律速段階やマクロファージ寄与率などの精緻な解析結果を報告しました2).最近では,COVID-19に対するワクチンで注目されている,mRNA封入脂質ナノ粒子のPET動態研究において,血液中でのapoEとのプロテインコロナ形成過程を示す特徴的な動態プロファイルの観察に初めて成功したことも重要な成果です(図1)3,4).
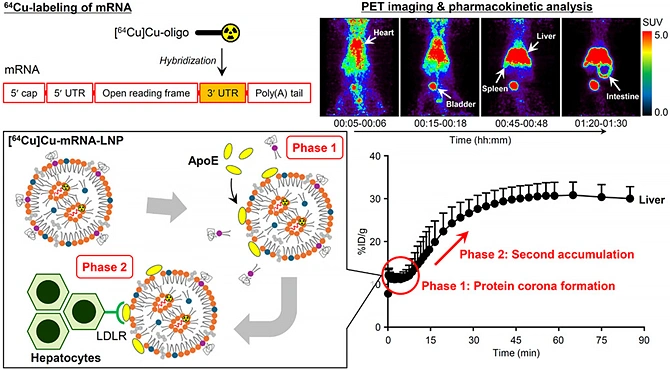
2)プレシジョンPET画像診断薬の開発
また,PET動態研究で得られた知見のニューモダリティPET画像診断薬開発への展開も進めています.一つは,浸潤・転移や抗がん剤耐性獲得などのがん悪性化に寄与する,活性型肝細胞増殖因子(HGF)特異的な環状ペプチドPETプローブの創出です.共同研究グループと共に,in vivoで活性型HGFの特異的可視化に世界で初めて成功いたしました(図2)5,6).二つは,抗体を使ったPET(免疫PET)のコントラストの劇的な改善です.抗体のクリアランスの遅さから,免疫PETでは十分なコントラストを得るのに時間がかかることが大きな課題ですが,酵素薬剤投与によって,血液中で抗体から放射性核種をトリガー式に解離させクリアランスする戦略を提唱し,担がんモデルで有効性を実証しました(図3)7).
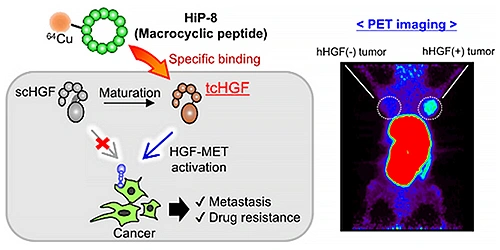
(American Chemical Societyから許可を得て転載,doi: 10.1021/acs.molpharmaceut.2c01020)
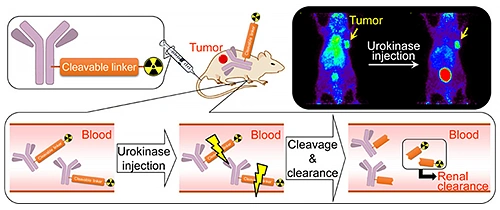
(American Chemical Societyから許可を得て転載,doi: 10.1021/acs.molpharmaceut.8b01052)
3)難治性がん治療用デザイナー細菌の開発
さらに,生きた細菌(生菌製剤)を難治性がん治療へ応用する研究を行っております.このなかで,2つの発見をしました.難治性がんや再発がんは間質成分が豊富で,これが様々ながん標的DDS製剤の腫瘍移行の大きな障壁であり,解決のための多くの挑戦が行われていることは周知の通りです.第一に,サルモネラ弱毒化株VNP20009が,間質が非常に豊富な難治性担がんマウスモデルの腫瘍深部にまで侵入して爆発的に増殖すること,それに伴って,腫瘍内の壊死領域が大きく拡大すること,すなわち,VNP20009が腫瘍間質を破壊している可能性を見出しました8).第二に,このVNP20009の腫瘍間質構造をこじ開ける力を発展させ,リポソーマル抗がん剤(ドキシルやオニバイド)の腫瘍深部への移行を劇的に改善できることを見出しました.さらに,驚くことに,VNP20009とリポソーマル抗がん剤の併用により,間質が非常に豊富なBxPC-3腫瘍を完全に退縮させることに成功し,腫瘍間質オープニング能として提唱しました(図4)9).
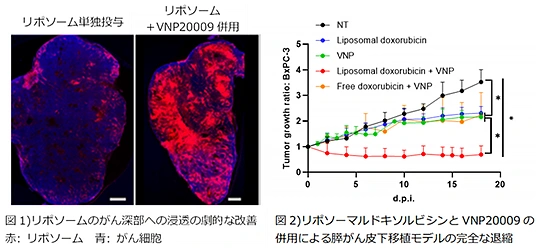
(長崎大学プレスリリース,doi: 10.1016/j.jconrel.2025.02.064)
最後になりますが,改めまして,常に厚いご指導,温かい励ましを頂戴しております橋田 充先生,渡辺恭良先生,川上 茂先生に深く感謝申し上げます.理化学研究所時代から現職の長崎大学においても,長く共に研究を進めていただいている毛利浩太先生,藁科翔太先生,野村祥子先生に日頃より心から感謝しております.また,これまで共同研究をさせていただきましたアカデミアや企業研究者の先生方,一緒に研究を進めていただいた学生の皆さんに感謝いたします.AMED創薬基盤推進研究事業や次世代がん医療加速化研究事業,科研費,武田科学振興財団,持田記念医学薬学振興財団,新日本先進医療研究財団,ひょうご科学技術協会などからいただきました多くのご支援に深く感謝申し上げます.この受賞を機に,さらに研究・教育に一層尽力して参る所存です.引き続き,ご指導ご支援のほど,どうぞよろしくお願い申し上げます.

