アドメサークル
 |
日本の薬物動態研究組織(9)
|
1. はじめに
創薬は1人ではできませんし,新薬の申請・承認から市販まで考えると1企業でも難しいと思います.そこにはグローバルな市場があって,日米欧を中心とする規制当局からのさまざまな要件があり,この枠組みの中でアカデミアを巻き込んだ製薬企業の切磋琢磨の中から,これまで全く予想されなかったような新薬が創出されてきました.
今回は,「協力」と「レギュラトリーサイエンス」をテーマに製薬企業とアカデミアとの接点を取り上げます.創薬研究は,0から1の発見と,1から2への応用,続いて2から100へと多くの検証が必要と思います.私たちが経験した,アカデミアを巻き込んだ製薬企業チームの研究を取り上げました.また,ガイドラインあるいはガイダンスが成立するためには産官学の協力が不可欠で,その「産業」のパートを支えている製薬協の活動を紹介します.患者さんのための創薬は,時間と費用と知恵の積み重ねになり,「効率」を目指すとき,産官学のロスのない知恵の接点が大切と思います.
2. キメラマウス肝細胞を用いたヒトCYPに関する研究
薬物間相互作用の評価には薬物代謝の種差を考慮してヒト試料を用いた試験が推奨されており,酵素阻害の研究にはヒト肝臓ミクロゾームが利用され,また酵素誘導の研究にはヒト肝細胞が利用されます.
遺伝的に免疫不全で肝障害を有するuPA+/+/SCIDマウス(生後20から30日齢)に,ヒト肝細胞をドナーとして移植して作製された「キメラマウス」が広島県地域結集型共同研究事業(研究統括:広島大学大学院理学研究科教授 吉里勝利先生)により開発されました1).我々も堀江透先生(ディ・スリー研究所)の紹介で吉里先生とキメラマウスを用いた共同研究を開始しました.2002年から「厚生労働科学研究費補助金(萌芽的先端医療技術推進研究事業)ヒト肝細胞キメラマウスを用いた医薬品の動態および安全性予測システムの構築」研究班(研究代表者:金沢大学大学院薬学研究科教授 横井毅先生)がスタートし,さらにヒト肝細胞キメラマウス研究会(会長:吉里勝利先生,副会長:横井毅先生)が発足し,我々を含めて9社ほどの企業と,4大学が研究に参加しました.金沢大学からは横井先生に加えて中島美紀助教授と加藤美紀助手がキメラマウス研究会に参加され,研究を大いに盛り上げていただきました.
我々は,既に研究員の西村益浩さんを中心にリアルタイムRT-PCRによる,ヒト肝細胞における薬物代謝関連酵素およびトランスポーターのmRNAの高感度分析法を開発しており,ヒト肝細胞を用いて誘導薬による酵素誘導能をmRNAレベルで評価した結果,酵素誘導の検討が可能であることを示しました2).この得意技をキメラマウスにおける薬物代謝酵素およびトランスポーターの発現解析に利用しました.横井先生の協力を受け,研究員の吉次博紀さんが加わりキメラマウスにおけるmRNA発現量はハウスキーピング酵素のmRNA発現量を内部標準とした存在比を定量的に解析した結果,肝臓には薬物動態に重要な多くの代謝酵素とトランスポーターが発現していました.3例のキメラマウスを用いてCYP分子種のmRNA発現状態について検討しました.使用したキメラマウスはマウス肝臓からヒト肝臓への置換率は81%でした.ドナーのヒト肝臓と比較したキメラマウスの肝臓でのCYP分子種のmRNA発現量の比率は平均で0.37であり,CYP1A2は0.58,CYP3A4は0.23でした3).ただしドナーの肝臓におけるCYP2A6 mRNAのGAPDH(ハウスキーピング遺伝子)に対する発現比率は0.0016であり,平均の0.37と比較して異常に小さい値でした3).この異常値は,CYP2A6に関しての加藤美紀先生らの報告によると,今回の試験に用いたドナーとそのドナーから作製されたキメラマウスの両方ともがCYP2A6*4/CYP2A6*4の遺伝子型であり,このドナー由来のキメラマウスのタンパク発現型もドナーと同じであったことから,特有の遺伝子多型が原因であると考えられました4).一般的に代謝酵素の含量は,大きな幅が見られることも知られており,キメラマウス肝臓中の発現量の比率がドナー肝臓の数%〜500%の間であれば,薬物代謝酵素やトランスポーターのmRNA発現量について定量的な変動を評価することが可能と思われました.
ヒト肝細胞と,その細胞をドナーとして移植したキメラマウス肝細胞を用いて,それぞれを培養した時の培養時間に伴うヒトCYP mRNA発現量の推移を3時点(0, 24, 72 h)で比較しFig. 1に示しました5).ターゲットのヒトCYP mRNA発現量はヒトβ-actinに対する発現比率を求めて,x軸にドナーのヒト肝細胞を用いた結果を,y軸にキメラマウス肝細胞での結果を,それぞれ対数で表示しました.培養前(0時間)のヒトCYP mRNA発現量を比較すると,ヒト肝細胞とキメラマウス肝細胞での相関係数は低く,ヒト肝細胞の発現量よりもキメラマウス肝細胞での発現量が高い傾向でした.培養24時間後はy切片の低下が認められるものの,傾きは約0.6に推移し,培養72時間後では良好な相関係数を示しました.この研究では,ヒト肝細胞を移植したキメラマウスから得られたヒト肝細胞であっても,培養系での挙動は徐々にドナーのヒト初代培養肝細胞に近づいているのが興味深く観察されました.
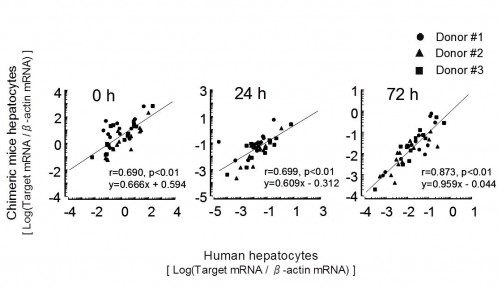
Fig. 1 Correlation between mRNA levels of human CYPs expressed in hepatocytes from chimeric mice and donor (0, 24, 72 h). Expression of human CYPs mRNA in chimeric mouse and donor hepatocytes is shown on the y axis and x axis, respectively. Data are presented on a logarithmic scale.
Data are expressed as ratios of human CYP1A1, CYP 1B1, CYP 1A2, CYP 2A6, CYP 2B6, CYP 2C8, CYP 2C9, CYP 2C18, CYP 2C19, CYP 2D6, CYP 2E1, CYP 3A4, CYP 3A5 and CYP3A7 mRNA to human β-actin mRNA in chimeric mouse and human hepatocytes.
キメラマウスの肝臓には多くのヒト型の薬物代謝酵素やトランスポーターが発現しており,阻害や誘導による薬物間相互作用の評価に有用であることから,ヒト肝臓試料を用いた研究と同様に医薬品開発に有効な試験方法と考えられます.キメラマウスは,特定のドナーからの肝細胞を移植して作製できるため,CYP2A6の事例4)のように遺伝子変異を持ったドナーの肝臓を有するキメラマウスを作製することもできます.さらに,ヒト肝細胞を移植したキメラマウスの肝細胞は,培養によりヒト肝細胞と同程度のmRNA発現レベルを示し,ドナーの性状を反映したin vitro試験系となることが明らかになりました5).またキメラマウスから調製した肝細胞を用いて典型的な誘導薬による酵素誘導能をmRNAレベルで評価した結果,十分にヒト肝細胞の代替実験が可能であることを示しました5).
以上の研究により,キメラマウス肝細胞は,誘導薬の曝露により,ドナーのヒト肝細胞と同様のヒトCYP誘導能を検出することができる優れた試験系であり,ヒト肝臓試料の代替になることを示しました.
3. ヒト薬物性肝機能障害の発現機構に関する研究
医薬品の開発においてヒト特異的に発生する薬物性肝機能障害を早期に予測することは重要な課題です.通常,げっ歯類および非げっ歯類を用いた毒性試験によってヒトでの反応性を予測していますが,実験動物で観察されなかった肝機能障害が臨床試験ステージあるいは市販後に発現することもあります.そこで,臨床試験においてヒトにおいてのみ肝機能障害が観察されたモデル化合物として末梢神経因性疼痛抑制作用を有するOT-7100(5-n-butyl-7-(3,4,5-trimethoxybenzoylamino)pyrazolo[1,5-a]pyrimidine)の研究を紹介します.研究員の栗林俊治さんが中心となり,本化合物の特性について北海道大学大学院薬学研究科教授 鎌滝哲也先生と助教授 山崎浩史先生に相談に乗っていただきました.その後,山崎先生には昭和薬科大学薬物動態学研究室に教授として赴任された後もご指導を賜りました.
静脈内投与されたOT-7100はラットとサルは同様の濃度推移を示し,イヌはラットおよびサルよりも速い親化合物の消失を示しました.一方,経口投与されたOT-7100のバイオアベイラビリティ(BA)はラット,イヌおよびサルでそれぞれ,36%,17%および0.3%となり,大きな種差が認められました.OT-7100の主代謝経路はアミド結合部分の加水分解によってM-19(trimethoxy体)とM-5(pyrazolo-pyrimidine体)が生成する経路でした.肝臓と小腸試料を用いた検討から,OT-7100の加水分解活性に種差を発見し,経口投与されたOT-7100のBAを決定する因子として,小腸と肝臓における加水分解代謝が重要と考えました.OT-7100がサル小腸に存在するエステラーゼの特異的基質であることが,ラットおよびイヌに比較してサルにおける低いBAの原因であると示唆されました6).
さて,臨床試験でOT-7100投与によって生じたヒトの肝機能障害の発生機序を検討しました.まず,肝機能障害の原因として活性代謝物(キノンイミン体)を推定しました.キノンイミン体はOT-7100よりM-5,M-5の水酸化体のM-23OHを経て生成されます.ヒトとラットではOT-7100代謝における第1ステップの酸化代謝とアミド結合部分の加水分解に大きな差はありません.CYP1A2が関与するM-5からM-23OHの代謝過程にヒトとラットの種差を発見しました.ヒトにおいてのみ発現した肝機能障害はヒトとラットにおけるCYP1A2の機能の違いに起因したM-23OHから生成するキノンイミン体とタンパク質との不可逆結合によるものと考えられました7).
さらに,ヒト-キメラマウス(フェニックスバイオ)に,14C-M-5を投与し肝臓試料からミクロゾームとサイトゾールを調製(積水メディカル)して,結合蛋白の解析のために二次元電気泳動(東和環境科学)を行いました.そして主要なマーカー蛋白部分を分取してAMS(Accelerator Mass Spectrometry)で放射活性を測定(加速器分析研究所)することで,14C-M-5由来放射能の蛋白へのcovalent bindingプロファイルを分析しました.この共同研究により,肝機能障害を有するOT-7100の代謝(M-5由来の代謝過程)に伴う非特異的なcovalent bindingを観察することができました.肝機能障害の種差を考える場合,ヒト肝細胞を有するキメラマウスはヒト特異的代謝物および肝機能障害の予測に有用であることが判明しました8,9).
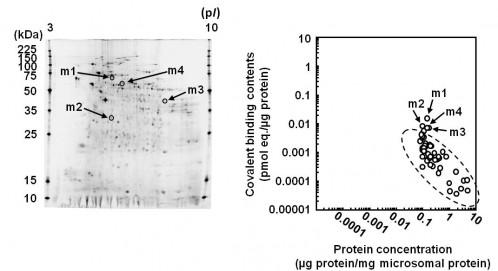
Fig. 2 Covalent binding profiles of liver microsomal protein from the chimeric mice with humanized liver after administration of 14C-substrate.
m1:Prolyl-4-Hydroxylase a, PDI
m2:3-Hydroxyanthranilic Acid Dioxygenase
m3:Branched-Chain-Amino-Acid Aminotransferase, NML
m4:Acetaminophen Binding Protein
このように,OT-7100によって惹起される肝機能障害は,肝臓で生成した活性代謝物が肝臓のタンパク質と不可逆的な結合物を生成するためと推察されました.この活性代謝物の生成過程にはヒトとラットに種差が存在し,ヒトにおいてのみ肝機能障害が観察された理由の一つであると考えられました.代謝物が肝臓中タンパク質と不可逆的結合物を生成するのに伴い,代謝過程でのグルタチオンの不足が肝臓および血液中グルタチオン濃度の低下として観察されます.つまりは,組織中グルタチオン濃度を指標に肝機能障害を予測することができると考えられました.さらに,肝機能障害の種差を考えた場合,ヒト肝細胞を用いて細胞内グルタチオン濃度の変動を指標としたin vitroスクリーニング系がヒトにおける肝機能障害の予測に非常に有用であることが明らかとなりました.
4. レギュラトリーサイエンスの発展と企業研究者の関わり
探索研究から創薬研究に進み,臨床開発を経て新薬申請から承認の可否となり,上市すれば,市販後研究となります.この過程では科学的な妥当性に加えて規制要件への対応が重要でありレギュラトリーサイエンスの出番です.さて厚生労働省から発出される規制要件の成立過程を見ますと,産官学の知恵を集めた内容に総括されてきているのが良く分かります.つまり,規制とは官からの要求事項ではなく,SOP(標準操作手順書)のように,だれもが一般的に実施可能な方法論を科学的に集めたものとなっています.
このレギュラトリーサイエンスの非臨床薬物動態試験の部分を製薬企業側で支えている団体に日本製薬工業協会(製薬協,JPMA)があります.製薬協の上位団体は日本製薬団体連合会(日薬連)になります.製薬協は研究開発志向型の製薬企業72社(2014年現在)が加盟する任意団体です.製薬産業に共通する諸問題の解決や医薬品に対する理解を深めるために活動し,国際的な連携を目的に,製薬協は米国研究製薬工業協会(PhRMA)や欧州製薬団体連合会(EFPIA)とともに,「日・米・欧」という世界の医薬品市場における3極の製薬団体として活動を展開し,医薬品規制の国際的な調和をめざす日米EU医薬品規制調和国際会議(ICH)の主要メンバーとして活動しています.製薬協には13の委員会組織があり,その1つの医薬品評価委員会の中に基礎研究部会があり,この部会には毒性試験,薬理試験そして薬物動態試験に携わる研究者が参加しています.
私は長らく製薬協・基礎研究部会に参加し,薬物動態担当の副部会長として所属し,薬物動態課題対応チームのリーダーを務めました.2010年頃は王鞍孝子さん(丸石製薬),河島浩輔さん(中外製薬),続いて,倉橋良一さん(日本たばこ)にサブリーダーをお願いして製薬協の活動を支えていただきました.現在は,三浦慎一さん(第一三共)が副部会長を務め,倉橋良一さんと古田盛さん(ゼリア新薬工業)が薬物動態関連のチームリーダーを務めておられます.
2010年頃は30社ほどの製薬企業研究者が参加し,5チームに分かれて課題に取り組んでいました.年に数回のミーティングとメールによる情報交換を通じて,薬物動態に関わるレギュラトリーサイエンスを議論し,アンケート調査,学会報告,論文発表,当局との協議,ICHでの議論に繋げていました.この頃に取り組んでいました課題は5項目(代謝物,分析法,トランスポーター,探索試験,iPS)でした.さらに,マイクロドーズ試験と日中韓の民族的要因については産官学で構成する外部委員会に参加していました.次に,製薬協活動の成果として「代謝物の安全性評価」に関して示します.
医薬品開発においては,代謝物のプロファイリング,薬理活性スクリーニング等を通じてヒトでの安全性を予測し,臨床薬物動態試験と,さらに放射性標識体(RI)を用いた臨床試験等の情報も加えて代謝物に関する安全性を評価しており,また,必要に応じて代謝物標品を用いた安全性試験を計画します.日本では,ICH M3(R2)ガイダンス10)さらにはICH M3(R2) Q&A11)を根拠に,FDAの通称「MISTガイダンス」12)を参照して,代謝物に関する安全性試験を実施することになります.医薬品評価フォーラムのキックオフミーティング(2007年)では,基礎から臨床まで産官学が一堂に会して医薬品の代謝物の非臨床安全性評価について議論し,画期的新薬を目指して方向性を提案しました13).さらに,アンケート調査を経て,第37回日本トキシコロジー学会学術年会シンポジウム「医薬品代謝物の安全性評価」(2010年)で議論し,この成果を基に,産と官が協力してヒト代謝物への取り組みの展望を示しました14).
代謝物の安全性評価は3つの段階に分けることができます14).すなわち,ヒト代謝物を推定しリスクの有無を予測する段階(MIST1),代謝物を用いた非臨床安全性試験の実施を判断する段階(MIST2),代謝物の非臨床安全性試験を実施する段階(MIST3)となります.MIST1では,特異的代謝物を含めたヒト代謝プロファイルのin vitro試験による推定,反応性代謝物等懸念すべき代謝物の推定,in silicoでのstructural alertの確認,安全性試験に用いる動物種の選定,代謝物曝露量評価方法の検討などが挙げられます.MIST2では,単回または反復投与臨床試験において,曝露量が投与薬物に関連する総ての物質の曝露量の10%を超えるヒト代謝物を確認し,毒性試験での最大曝露量と比較します.その結果から,代謝物非臨床安全性評価の実施の要否を決定します.MIST3では,種々の安全性評価項目について一般毒性試験に組み込むことの可能性を検討し,必要であれば適切な試験を実施することになります.
代謝物の安全性評価においては,検討時期の目的に応じた代謝物の定量法や代謝物標品を適切に準備することが非常に重要となり,さらに効率的な試験を目指す必要があります.臨床試験で得られたヒト試料を分析し,ヒト特異的代謝物か主要代謝物であるかなどを判断することは極めて重要です.しかし,代謝物標品の準備を含め,これらの評価研究は医薬品開発の律速となることもあり,薬のリスクとベネフィットを考え,場合により医薬品医療機器総合機構(PMDA)の各種相談制度等を活用して最善の方法を選択すべきものと考えます.医薬品開発の過程では,臨床第1相試験が終わった頃にヒト代謝物のプロファイルが判明することが多いため,代謝物の情報によっては開発のスローダウンもありえます.
一方,反応性代謝物は臨床で問題となっても通常の毒性試験で確認できないことが多く,ヒト試料を使ったスクリーニング系等でチェックし,代謝物の反応性に関する情報を動物と比較して検討します.臨床の面から考えると,医療現場での情報を医薬品開発にフィードバックすることにより,例えば使用法の改良等に反映させることも考えられます.しかしながら,実際に問題が起こっている割合は非常に少なく,非臨床において簡単に発見できるような問題ではないのかもしれません.したがって,問題が起こった時点で,できるだけ迅速な対応により解決の方向性を見出すことが重要ではないでしょうか.
このように考えてくると,医薬品代謝物の安全性評価は大きな課題であり,ひとつの理論的枠組みでの判断は困難であることから,有用な医薬品をなるべく早く開発するために基本的にはケースバイケース的な対応が必要となります.また,科学的に無意味な試験は省くことにより,良質な医薬品を医療の現場に速やかに提供することが重要と考えます.
5. まとめ
グローバルな創薬を目指したときのチーム力を課題に話を進めてきました.キメラマウスの研究はいかがでしょうか.最近ではキメラマウス(現在はPXBマウスと表記)を用いた研究が進み,探索研究では貴重な実験動物として数多く利用されるようになってきました.キメラマウス利用の方法論は成熟してきましたが,まだまだ応用範囲の広いツールのように思いますので,ぜひ新しい研究から有効な新薬開発を促進してください.反応性代謝物の研究はいかがでしょうか.ネットワーク研究の事例です.他にも,まさに泥沼?の中から手づかみで得た輝く知見が数多く報告され,未来への情報の橋渡しが進んでいます.反応性代謝物を最初から回避せずに,積極的に乗り越えていただければと思います.レギュラトリーサイエンスは明確な科学分野として成長しています.ぜひ製薬協の活動に参加してサイエンスをドライブして下さい.
今回はアカデミアを加えた企業のチーム研究と,製薬協でのレギュラトリーサイエンスを紹介しました.繰り返しになりますが,「科学的に無意味な試験は省くこと」が大切と考えています.経験は利用することによりさらに大きな経験になり,創薬は上質な経験(失敗の解明)を超えたところに成功があるのかもしれません.
なお,本稿で実名を挙げた方の他にも,多くの企業研究者の皆さまと先生方の支援がありましたことを,ここに深く感謝いたします.私からのメッセージはこのあたりで終わりにさせていただきます.4回に渡っての連載にお付き合いをいただきありがとうございました.
参考文献
- Tateno, C., Yoshizane, Y., Saito, N., Kataoka, M., Utoh, R., Yamasaki, C., Tachibana, A., Soeno, Y., Asahina, K., Hino, H., Asahara, T., Yokoi, T., Furukawa, T. and Yoshizato, K.: Near completely humanized liver in mice shows human-type metabolic responses to drugs. Am. J. Pathol., 165: 901-912 (2004).
- Nishimura, M., Yoshitsugu, H., Naito, S. and Hiraoka, I.: Evaluation of gene induction of drug-metabolizing enzymes and transporters in primary culture of human hepatocytes using high-sensitivity real-time reverse transcription PCR. Yakugaku Zasshi, 122: 339-361 (2002).
- Nishimura, M., Yoshitsugu, H., Yokoi, T., Tateno, C., Kataoka, M., Horie, T., Yoshizato, K. and Naito, S.: Evaluation of mRNA expression of human drug-metabolizing enzymes and transporters in chimeric mouse with humanized liver. Xenobiotica, 35: 877-890 (2005).
- Katoh, M., Matsui, T., Nakajima, M., Tateno, C., Kataoka, M., Soeno, Y., Horie, T., Iwasaki, K., Yoshizato, K. and Yokoi, T.: Expression of human cytochromes P450 in chimeric mice with humanized liver. Drug. Metab. Dispos., 32: 1402-1410 (2004).
- Yoshitsugu, H., Nishimura, M., Tateno, C., Kataoka, M., Takahashi, E., Soeno, Y., Yoshizato, K., Yokoi, T. and Naito, S.: Evaluation of man CYP1A2 and CYP3A4 mRNA expression in hepatocytes from chimeric mice with humanized liver. Drug. Metab. Pharmacokinet., 21: 465-474 (2006).
- Kuribayashi, S., Ueda, N., Naito, S., Yamazaki, H. and Kamataki, T.: Species differences in hydrolase activities toward OT-7100 responsible for different bioavailability in rats, dogs, monkeys and humans. Xenobiotica, 36 :301-314 (2006).
- Kuribayashi, S., Goto, K., Naito, S., Kamataki, T. and Yamazaki, H.: Human cytochrome P450 1A2 involvement in the formation of reactive metabolites from a species-specific hepatotoxic pyrazolopyrimidine derivative, 5-n-butyl-7-(3,4,5-trimethoxybenzoylamino)pyrazolo[1,5-a]pyrimidine. Chem. Res. Toxicol., 22: 323-331 (2009).
- Yamazaki, H., Kuribayashi, S., Inoue, T., Tateno, C., Nishikura, Y., Oofusa, K., Harada, D., Naito, S., Horie, T. and Ohta, S.: Approach for in vivo protein binding of 5-n-butyl-pyrazolo[1,5-a]pyrimidine bioactivated in chimeric mice with humanized liver by two-dimensional electrophoresis with accelerator mass spectrometry. Chem. Res. Toxicol., 23: 152-158 (2010).
- Kuribayashi, S., Uno, Y., Naito, S. and Yamazaki, H.: Different metabolites of human hepatotoxic pyrazolopyrimidine derivative 5-n-butyl-pyrazolo[1,5-a]pyrimidine produced by human, rat and monkey cytochrome P450 1A2 and liver microsomes. Basic Clin. Pharmacol. Toxicol., 110: 405-408 (2012).
- 医薬品の臨床試験及び製造販売承認申請のための非臨床安全性試験の実施についてのガイダンス(薬食審査発0219第4号 平成22年2月19日).
- 「医薬品の臨床試験及び製造販売承認申請のための非臨床安全性試験の実施についてのガイダンス」に関する質疑応答集(Q&A)(厚生労働省医薬食品局審査管理課事務連絡 平成24年8月16日).
- Guidance for Industry, Safety Testing of Drug Metabolites, FDA, CEDR, Published in Federal Register, February (2008).
- Naito, S., Furuta, S., Yoshida, T., Kitada, M., Fueki, O., Unno, T., Ohno, Y., Onodera, H., Kawamura, N., Kurokawa, M., Sagami, F., Shinoda, K., Nakazawa, T. and Yamazaki, T.: Current Opinion: Safety Evaluation of Drug Metabolites in the Development of Pharmaceuticals. J. Toxicol. Sci., 32: 329-341 (2007).
- Minagawa, T., Nakano, K., Furuta, S., Iwasa, T., Takekawa, K., Minato, K., Koga, T., Sato, T., Kawashima, K., Kurahashi, Y., Onodera, H., Naito, S. and Nakamura, K.: Perspectives on non-clinical safety evaluation of drug metabolites through the JSOT workshop. J. Toxicol. Sci., 37: 667-673 (2012).
