技術・研究材料紹介(企業広告)
不死化ヒト肝細胞 Corning® HepatoCells についてコーニングインターナショナル株式会社ライフサイエンス事業部
|
はじめに
薬物動態研究における試験系のひとつとして凍結初代肝細胞が使用されている.肝細胞は細胞としての構造と機能,各種の生物学的制御機構を保持している点で他の系にない特長を有しているが,一方でドナー(ロット)による差異が無視できぬほどに大きいことや,正常な肝細胞の性質を保った状態でそれをインビトロで増殖させることはできない等の限界がある.医薬品開発上の試験に肝細胞を使用する場合には,細胞ロットごとに特性確認をした上で試験に使われるが,せっかくそれを行ったロットでも供給量には限りがあり,それがなくなれば次のロット探索と確認試験を反復しなければならないといった問題も存在する.
Corning HepatoCellsは当社の特許不死化技術によりヒト初代肝細胞から作製したシングルユースの凍結細胞である.製造施設においては同一形質の細胞を無制限に製造可能であり,それを有限寿命の細胞とした上で供給している.そのため製造ロット間差は僅少であり,スクリーニング段階での酵素誘導試験や肝毒性評価のツールとして有用と考えている.
主な薬物代謝酵素の遺伝子型と細胞形態
表1に本細胞の主要チトクロームP450(CYP)遺伝子型を示す.調べた分子種の遺伝子型は酵素活性変化を伴わないものであった.図1は付着細胞層の顕微鏡写真である.本細胞は典型的な成熟肝細胞様の単一細胞集団であった.さらにHepatoCellsは凍結初代肝細胞のように解凍時に遠心精製操作を行わなくても高生存率が得られ,未精製で播種してこのような細胞層を形成できた.
| CYP種類 | 遺伝子型 | 酵素活性 |
|---|---|---|
| CYP2D6 | *2/*2(変異型) | 正常 |
| *3, *4, *6, *7, *8, *9, *10 位置には変異なし(野生型) | 正常 | |
| CYP2C9 | *2, *3 位置には変異なし(野生型) | 正常 |
| CYP2C19 | *2, *3 位置には変異なし(野生型) | 正常 |
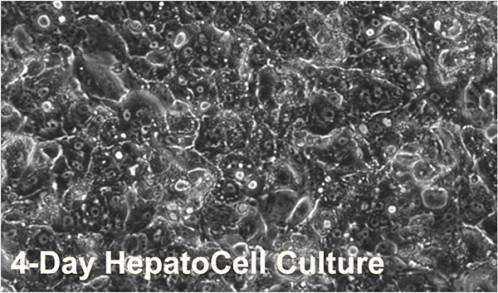
図1.コラーゲンI表面にプレーティングして4日目のHepatocells接着細胞層顕微鏡像
CYP誘導に関する特性
図2はCYP1A2,CYP2B6,CYP3A4の既知誘導剤に対する反応性とその複数ロットにおける変動幅を示す.HepatoCellsでのこれらの酵素誘導性は3分子種で初代肝細胞のそれに同水準であるとともにロット間変動は初代肝細胞に比べかなり小さかった.HepatoCellsにおけるロットとは単一ドナー初代肝細胞に由来する不死化細胞を小分けして凍結ストックし,1本のストックバイアルから製造した1群のシングルユース細胞を意味する.本グラフでは誘導性は各酵素活性の非誘導時に対する倍率(fold induction)で評価しているが,HepatoCellsにおけるmRNAレベル上昇はCYP1A2(150~300倍),CYP2B6(5~8倍),CYP3A4(20~40倍)の結果を得ている.
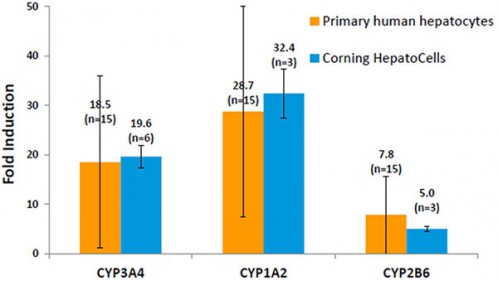
図2.CYP3A4,1A2,2B6酵素活性の誘導
各酵素に対して次の誘導剤/基質で活性の誘導を評価した.
CYP3A4 – rifampicin 10 mM/ testosterone;CYP1A2 – omeprazole 50 mM/phenacetin;
CYP2B6 – phenobarbital 1 mM/ bupropion. 誘導時間は全て72時間.
エラーバーは異なるロット間の標準偏差(SD)を示す.
肝毒性試験:スフェロイド培養での検討
コーニングでは容器表面にハイドロゲルを共有結合させて細胞の接着性を抑制した超低接着(ultra-low attachment)表面培養容器を提供しており,同表面を持った黒色クリアボトムU底の96または384ウェルプレートでは播種した細胞でスフェロイド形成してそれをそのまま解析できる.本プレートを用いてHepatoCellsでスフェロイド培養を試みた.図3の左側はその顕微鏡像で,データは示さないが最初に播種した細胞数とスフェロイド直径との間に比例関係が見られた.すなわち播種したほぼ全ての細胞が凝集してスフェロイド形成することが示された.またがん細胞スフェロイドとは異なり,形成後に寸法が増大することはなかった.図3の右側は培養4日目のスフェロイドに100μMのaflatoxin B1を24時間曝露した際のスフェロイド形状で,その崩壊と部分的な細胞死が始まっていることを示す.図4はHepatoCellsスフェロイドにaflatoxin B1を8濃度ポイントで24時間曝露した後のATPレベルに対する影響を示したグラフである.本細胞を用いることで初代ヒト肝細胞同様にスフェロイド形成ができ,それに対する毒性評価が実施できた.
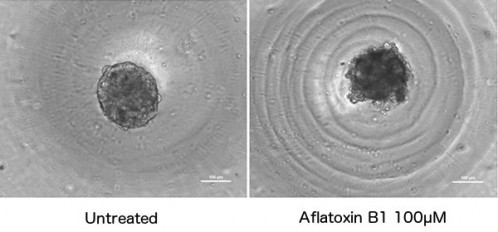
図3.Hepatocells 4日目スフェロイドに対するaflatoxin B1曝露の影響
培養4日目の正常HepatoCellsスフェロイド(1.5K cells/スフェロイド,左)と,それを100μM aflatoxin B1に24時間曝露した後のスフェロイド(右).スフェロイド周囲の環状模様はウェルU底底面の模様.バーの長さはともに100μm.
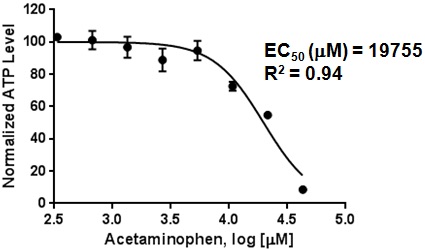
図4.Hepatocellsスフェロイド(4日目)に対するacetaminphen毒性効果の濃度依存性
4日目HepatoCellsスフェロイド(1.5K cells/スフェロイド)に肝毒性化合物acetaminophenを8濃度ポイントで24時間曝露した後に,プロメガ社製CellTiter-Glo®3D Cell Viability Assay kitでATP濃度を測定し細胞数(1.5K cells)で除してNormalized ATP levelとした.データの解析はGraphPad Prismソフトを用いて行った.エラーバーはn=3の標準偏差(SD)を示す.
カルタヘナ法上の規制区分
HepatoCells作製の遺伝子操作には,第一段階としてレンチウイルスを用いた不死化遺伝子の導入,第二段階としてアデノウイルスを用いた不死化遺伝子除去が行われている.最終製品はレンチウイルス遺伝子および粒子残存のないことを確認している一方で,平均して2.5×105PFU/vial(by plaque assay)のアデノウイルスが存在し,HepatoCellsはカルタヘナ法において実験分類クラス2の規制対象となる.
